题目内容
【题目】下列说法正确的是( )
A.常温下,反应NH3(g)+HCl(g)=NH4Cl(s)能自发发生反应,则该反应的△H>0
B.常温下,等物质的量浓度的CH3COOH溶液和HCl溶液中,水的电离程度相同
C.常温下,0.1molL﹣1CH3COONa溶液加水稀释后,溶液中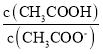 的值增大
的值增大
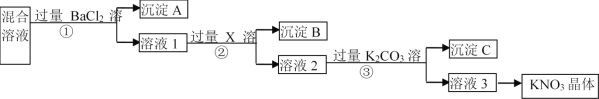
D.常温下,向BaCO3、BaSO4的饱和溶液中加入少量BaCl2固体,溶液中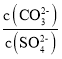 减小
减小
【答案】C
【解析】
A.△H-T△S<0反应自发,反应NH3(g)+HCl(g)=NH4Cl(s)是熵减反应△S<0,只有△H<0才可能能使△H-T△S<0,故A错误;
B.醋酸为弱酸,等浓度的醋酸和盐酸,醋酸电离出的氢离子浓度较小,对水的电离抑制作用较小,故B错误;
C. ,加水稀释溶液碱性减弱,氢离子浓度增大,电离平衡常数不变,所以
,加水稀释溶液碱性减弱,氢离子浓度增大,电离平衡常数不变,所以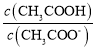 增大,故C正确;
增大,故C正确;
D.混合溶液中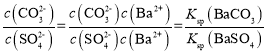 ,加入少量氯化钡固体,温度不变,则比值不变,故D错误;
,加入少量氯化钡固体,温度不变,则比值不变,故D错误;
故答案为C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】下列实验操作、现象和结论均正确,且存在对应关系的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将NaOH溶液逐滴滴加到AlC13溶液中至过量 | 先产生白色胶状沉淀,后沉淀溶解 | Al(OH)3是两性氢氧化物 |
B | NaHCO3溶液与NaAlO溶液混合 | 生成白色沉淀 | 结合H+的能力:CO32->AlO2- |
C | 向盛有Na2SiO3,溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至过量 | 试管中红色逐渐褪去,出现白色凝胶 | 非金属性:Cl>Si |
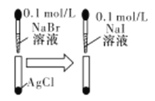
D |
| 白色固体先变为淡黄色,后变为黄色 | 溶度积常数:Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI) |
A.AB.BC.CD.D