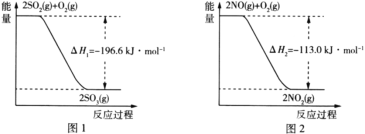
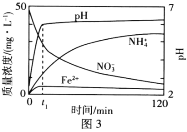
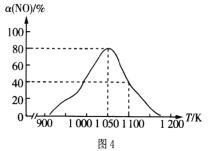
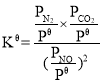��Ŀ����
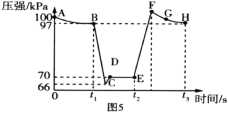
����Ŀ���ڢ١��ڡ����ݻ����ȵĺ����ܱ������У�������0.1molCO��0.2molH2���ڴ����������·�����Ӧ��CO(g)+2H2(g)![]() CH3OH(g)���������������ƽ��������CH3OH������������¶ȵı仯��ͼ��ʾ������˵����ȷ���ǣ� ��
CH3OH(g)���������������ƽ��������CH3OH������������¶ȵı仯��ͼ��ʾ������˵����ȷ���ǣ� ��
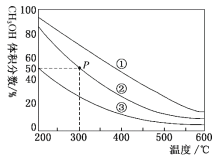
A.�÷�Ӧ������ӦΪ���ȷ�Ӧ
B.���������ݻ�����>��>��
C.��P�㣬COת����Ϊ75%
D.��P�㣬�����������ٳ���CO��H2��CH3OH��0.025mol����ʱv(CO)��>v(CO)��
���𰸡�CD
��������
A��ͬһ�����У������¶ȣ��״������������С��˵�������¶�ƽ�������ƶ���������Ӧ�Ƿ��ȷ�Ӧ����A����
B����ͬ�¶��£�����ѹǿ(��С�����ݻ�)ƽ�������ƶ�����״����������������ͼ֪����ͬ�¶��¼״������������С˳���ǣ��٣��ڣ��ۣ�˵��ѹǿ��С˳���ǣ��٣��ڣ��ۣ����������Ϊ���٣��ڣ��ۣ���B����
C��P�㣬�����м״������������50%�����ʱCO��ת����Ϊx��������ʽ��
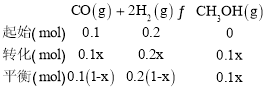
ͬһ���������������������������ʵ�������������![]() =50%�����x=0.75��CO��ת����Ϊ75%����C��ȷ��
=50%�����x=0.75��CO��ת����Ϊ75%����C��ȷ��
D�����������ΪVL��P�㻯ѧƽ�ⳣ��K=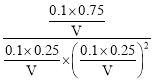 =1200V2�������������ٳ���CO��H2��CH3OH��0.025mol����ʱŨ����=
=1200V2�������������ٳ���CO��H2��CH3OH��0.025mol����ʱŨ����=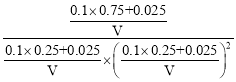 =355.5V2��K����ƽ�������ƶ������Դ�ʱv(CO)����v(CO)������D��ȷ��
=355.5V2��K����ƽ�������ƶ������Դ�ʱv(CO)����v(CO)������D��ȷ��
�ʴ�ΪCD��

����Ŀ���±���һЩ������ȼ���ȣ������б�����ȷ����
������ | ȼ����/ kJ��mol-1 | ������ | ȼ����/ kJ��mol-1 |
���� | 891.0 | ������ | 2878.0 |
���� | 1560.8 | �춡�� | 2869.6 |
���� | 2221.5 | ������ | 3531.3 |
A. �������ȼ���ȴ���3531.3 kJ��mol-1
B. ��ͬ������������̼����������Խ��ȼ�շų�������Խ��
C. ������ת��Ϊ�춡����Ȼ�ѧ����ʽΪ��CH3CH2CH2CH3(g) ![]() CH3CH(CH3)CH3(g) ��H =+8.4kJ��mol-1
CH3CH(CH3)CH3(g) ��H =+8.4kJ��mol-1
D. ����ȼ�յ��Ȼ�ѧ����ʽΪ��CH4(g)+2O2(g) ![]() CO2(g) +2H2O(g) ��H =-891.0kJ��mol-1
CO2(g) +2H2O(g) ��H =-891.0kJ��mol-1