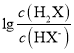题目内容
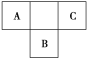
【题目】下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。
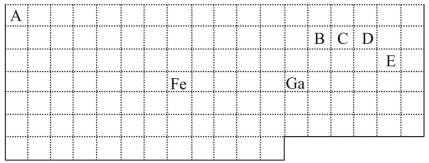
根据信息回答下列问题:
(1)周期表中基态Ga原子的电子排布式为___。
(2)Fe元素位于周期表的___分区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为___。
(3)已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为___和___(填化学式)。在CO、CH3OH中,碳原子采取sp3杂化的分子有___。
(4)根据VSEPR理论预测ED4-离子的空间构型为___。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子有__(任写2种化学式)。
【答案】1s22s22p63s23p63d104s24p1 d 0 N2 CN- CH3OH 正四面体形 CO2、NCl3、CCl4、CO(任写2个)
【解析】
(1)主族元素的族序数=其最外层电子数=其价电子数,最外层电子在排列时,遵循能量最低原理;
(2)元素周期表五区的划分是根据最后排入的电子名称命名的;Fe原子是26号元素,Fe原子的基态核外电子排布式为:1s22s22p63s23p63d64s2,这些电子排列时遵循能量最低原理(先排能量低的后排能量高的),这些能级的能量大小顺序为:1s<2s<2p<3s<3p<4s<3d,所以根据能量最低原理先排4s电子后排3d电子;Fe与CO易形成配合物Fe(CO)5,根据化合物的化合价代数和为0,所以Fe(CO)5的化合价代数和为0,CO是化合物,它的化合价的代数和是0,所以在Fe(CO)5中铁的化合价为 0;
(3)根据等电子体的定义,只要原子数目和电子总数(或价电子总数)相同就是等电子体,CO分子含两个原子,且组成该物质的元素一个是6号一个是8号,找它的等电子体时,如果是分子,就把两种元素的原子序数一个增大1一个减小1,如果是离子,其中一种元素不变,另一种原子序数增大(或减小),带正电荷(或负电荷);判断原子采取杂化方式时,先根据价层电子对互斥理论判断价层电子对,然后再确定采取的杂化方式,如:如果是直线型,采取的就是sp杂化;
(4)根据杂化轨道理论判断分子空间构型。
(1)31号元素Ga原子的电子排布式为1s22s22p63s23p63d104s24p1,故答案为:1s22s22p63s23p63d104s24p1;
(2)26号元素Fe元素在周期表的位于第四周期第Ⅷ族,位于周期表的d区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为0价,故答案为:d;0;
(3)与CO分子互为等电子体的分子是N2,离子为CN-;在CO、CH3OH中,碳原子采取sp3杂化的分子有CH3OH;CO中的C原子的杂化方式为sp杂化,故答案为:N2;CN-;CH3OH;
(4)根据表格中各种元素的相对位置可以看出:A是H;B是C;C是N;D是O;E是Cl,则ED4-离子ClO4-离子,价层电子对数=σ键电子对数+中心原子上的孤电子对数,σ键电子对数=σ键个数=中心原子结合的原子个数,中心原子是Cl原子,中心原子结合的原子个数是4,所以σ键电子对数=4,中心原子上的孤电子对数=1/2(a-xb),说明:x为配位原子个数,b为配位原子最多能接受的电子数,对于阴离子,a为中心原子的价电子数+离子所带的电荷数,中心原子上的孤电子对数=1/2(a-xb)=1/2(8-5×2)=0,所以价层电子对数=4,根据VSEPR理论预测ED4-离子的空间构型为正四面体型;在C、N、O、Cl原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子有CO2、NCl3、CCl4、CO(任写2个),故答案为:正四面体形;CO2、NCl3、CCl4、CO(任写2个)。

 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案