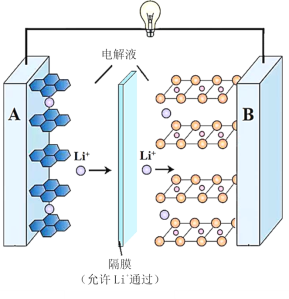
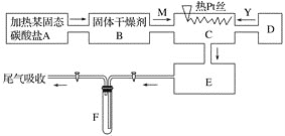
��Ŀ����
����Ŀ������ȼ��ʱ�������仯��ͼ���й�˵����ȷ���ǣ� ��
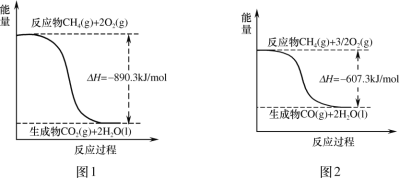
A.ͼ1�з�ӦΪ��CH4(g)+2O2(g)=CO2(g)+2H2O(l) H=+890.3kJ/mol
B.ͼ2�з�ӦΪ��CH4(g)+![]() O2(g)=CO(g)+2H2O(g) H=��607.3kJ/mol
O2(g)=CO(g)+2H2O(g) H=��607.3kJ/mol
C.��ͼ�����Ƶã�CO(g)+![]() O2(g)=CO2(g) H=��283kJ/mol
O2(g)=CO2(g) H=��283kJ/mol
D.��ͼ������֪�������ʵ�����CO2��CO��CO2���е�������
���𰸡�C
��������
A������ͼ���������Ӧ�����������������������������ͼ1�з�ӦΪ��CH4(g)+2O2(g)=CO2(g)+2H2O(l) H=-890.3kJ/mol��A����
B������ͼ�������������ˮ��״̬��Һ̬����ͼ2�з�ӦΪ��CH4(g)+![]() O2(g)=CO(g)+2H2O(l) H=��607.3kJ/mol��B����
O2(g)=CO(g)+2H2O(l) H=��607.3kJ/mol��B����
C��CO(g)+![]() O2(g)=CO2(g) ���ʱ�ɸ���CH4(g)+2O2(g)=CO2(g)+2H2O(l) H=-890.3kJ/mol�ͷ�ӦH=��283kJ/mol��CH4(g)+
O2(g)=CO2(g) ���ʱ�ɸ���CH4(g)+2O2(g)=CO2(g)+2H2O(l) H=-890.3kJ/mol�ͷ�ӦH=��283kJ/mol��CH4(g)+![]() O2(g)=CO(g)+2H2O(l) H=��607.3kJ/mol����ʱ�H=��283kJ/mol��C��ȷ��
O2(g)=CO(g)+2H2O(l) H=��607.3kJ/mol����ʱ�H=��283kJ/mol��C��ȷ��
D��CO(g)+![]() O2(g)=CO2(g) H=��283kJ/mol���÷�Ӧ���ȣ���Ӧ�������������������������������Ե����ʵ�����CO2��CO��CO���е������ߣ�D����
O2(g)=CO2(g) H=��283kJ/mol���÷�Ӧ���ȣ���Ӧ�������������������������������Ե����ʵ�����CO2��CO��CO���е������ߣ�D����
��ѡC��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����ϵΪԪ�����ڱ��е���B�塢ԭ������Ϊ57~71��Ԫ�ء�
��1����(Dy)�Ļ�̬ԭ�ӵ����Ų�ʽΪ[Xe]4f106s2��������(Dy)ԭ����Χ�����Ų�ͼ��___________��
��2�����³��������籵ͭ�������к���Cu3+����̬ʱCu3+ �ĵ����Ų�ʽΪ________________��
��3���۲�����������ϵԪ�صĵ������������ж����п�����ʾ+3 �۵�Ԫ����___________(��Ԫ������)��������ϵԪ�صĵ�����(��λ��kJ mol-1)
Ԫ�� | I1 | I2 | I3 | I4 |
Yb(� | 604 | 1217 | 4494 | 5014 |
Lu(�壩 | 532 | 1390 | 4111 | 4987 |
La(�磩 | 538 | 1067 | 1850 | 5419 |
Ce(�棩 | 527 | 1047 | 1949 | 3547 |
��4��Ԫ����(Ce)�����γ������(NH4)2[Ce(NO3)6]��
���������������Ԫ�����縺���ɴ�С��˳��Ϊ________________(��Ԫ�ط��ű�ʾ)��
��д�����������̬�⻯��ˮ��Һ�д��ڵ������__________________(��дһ��)��
��Ԫ��Al Ҳ�����Ƴɼ��������̬�Ȼ������ӱ�ʾΪ(AlCl3)2��������Al ԭ���ӻ���ʽΪ_____________��������������ѧ��������______________(����ĸ)��
a.���Ӽ� b.���Լ� C.�Ǽ��Լ� d.��λ��
��5��PrO2(��������)�ľ���ṹ��CaF2��������������ԭ��λ�����ĺͶ�������PrO2(��������)�ľ�������________����ԭ������֪��������Ϊa pm���ܶ�Ϊ�� g�� cm-3��NA=_____________ (�ú�a�����Ĵ���ʽ��ʾ)��