题目内容
【题目】铬是人体必需的微量元素,它与脂类代谢有密切联系,但铬过量会引起污染,危害人类健康。
(1)不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性约为三价铬的100倍。电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-,处理该废水常用的流程如下图所示:
![]()
Na2S2O3在此过程中表现________性。若向含Cr3+的废水中加入过量NaOH溶液,会得到NaCrO2溶液,NaCrO2中Cr元素的化合价为_________价,反应的离子方程式为______________________。
(2)交警常用一种“酒精检测仪”检测司机是否酒后驾车。其反应原理如下,请配平该反应方程式:
(_____)CrO3 +(_____)CH3CH2OH +(_____)H2SO4 —(_____)CH3CHO + (_____)Cr2(SO4)3+(_____)H2O
(3)已知存在平衡:2CrO42-+2H+![]() Cr2O72-+H2O。向K2Cr2O7溶液中加入Ba(NO3)2和Pb(NO3)2溶液,可析出BaCrO4和PbCrO4两种沉淀,反应的离子方程式为 (任意写出其中一种即可)。此时溶液中c(Pb2+):c(Ba2+)=_________________。
Cr2O72-+H2O。向K2Cr2O7溶液中加入Ba(NO3)2和Pb(NO3)2溶液,可析出BaCrO4和PbCrO4两种沉淀,反应的离子方程式为 (任意写出其中一种即可)。此时溶液中c(Pb2+):c(Ba2+)=_________________。
已知Ksp(BaCrO4)=1.25×10-10;Ksp(PbCrO4)=2.75×10-13;
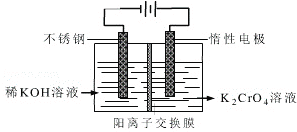
(4)工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备K2Cr2O7,制备装置如图所示(阳离子交换膜只允许阳离子透过)。通电后阳极的电极反应式为____________________。请结合方程式解释反应一段时间后,在阴极室得到浓KOH溶液的原因____________________。
【答案】还原 +3 Cr3++4OH-=CrO2-+2H2O 2 3 3 3 3 6 Cr2O72-+H2O+2Ba2+=2BaCrO4↓+2H+(或Cr2O72-+H2O+2 Pb2+=2PbCrO4↓+2H+) 2.2×10-3 2H2O-4e-=O2↑+4H+(或4OHˉ—4e-=O2↑+2 H2O),阴极室发生反应2H2O+ 2e-= H2↑+2OH-,c(OHˉ)增大;K+穿过阳离子交换膜进入阴极室,与OHˉ共同得到KOH
【解析】
(1)Na2S2O3是还原剂,把NaCrO2中Cr元素还原为+3价,生成的Cr3+与过量NaOH溶液反应生成CrO2-;
(2)该反应中Cr元素化合价由+6价变为+3价,C2H5OH中C元素化合价由-2价变为-1价,转移电子总数为6,据电子守恒、原子守恒配平方程式;
(3)根据浓度对平衡移动的影响规律进行分析;根据c(Pb2+):c(Ba2+)==Ksp(PbCrO4):Ksp(BaCrO4)进行计算;
(4)阳极发生氧化反应,OHˉ失电子生成O2,阴极室发生还原反应生成氢气,c(OH-)增大,K+穿过阳离子交换膜进入阴极室。
(1)Na2S2O3与六价铬发生氧化还原反应将六价的还原成+3价,所以Na2S2O3是还原剂,NaCrO2中Cr元素的化合价为+3价,向含Cr3+的废水中加入过量NaOH溶液,反应方程式为Cr3++4OH-=CrO2-+2H2O;
(2)该反应中Cr元素化合价由+6价变为+3价,C2H5OH中C元素化合价由-2价变为-1价,转移电子总数为6,根据转移电子相等知,CrO3的计量数是2,C2H5OH的计量数是3,再结合原子守恒配平方程式为2CrO3 +3CH3CH2OH +3H2SO4 =3CH3CHO+3Cr2(SO4)3+6H2O;
(3)加入Ba(NO3)2和Pb(NO3)2溶液,平衡:2CrO42-+2H+![]() Cr2O72-+H2O向逆反应方向移动,所以反应的离子方程式为Cr2O72-+H2O+2Ba2+=2BaCrO4↓+2H+(或Cr2O72-+H2O+2Pb2+=2PbCrO4↓+2H+);c(Pb2+):c(Ba2+)==Ksp(PbCrO4):Ksp(BaCrO4)=2.75×1013:1.25×1010=2.2×10-3;
Cr2O72-+H2O向逆反应方向移动,所以反应的离子方程式为Cr2O72-+H2O+2Ba2+=2BaCrO4↓+2H+(或Cr2O72-+H2O+2Pb2+=2PbCrO4↓+2H+);c(Pb2+):c(Ba2+)==Ksp(PbCrO4):Ksp(BaCrO4)=2.75×1013:1.25×1010=2.2×10-3;
(4)阳极发生氧化反应,电极反应式为4OHˉ-4e-=O2↑+2 H2O,阴极室发生反应2H2O+ 2e-= H2↑+2OH-,c(OH-)增大;K+穿过阳离子交换膜进入阴极室。
【点晴】
答题时注意沉淀溶解平衡的理解与计算,掌握基础是关键。难点是氧化还原反应方程式的配平。氧化还原反应的实质是反应过程中发生了电子转移,而氧化剂得电子的总数(或元素化合价降低总数)必然等于还原剂失电子总数(或元素化合价升高总数),根据这一原则可以对氧化还原反应的化学方程式进行配平。配平的步骤:(1)标好价:正确标出反应前后化合价有变化的元素的化合价。(2)列变化:列出元素化合价升高和降低的数值。(3)求总数:求元素化合价升高数和降低数的总数,确定氧化剂、还原剂、氧化产物、还原产物的化学计量数。(4)配系数:用观察法配平其他各物质的化学计量数。(5)细检查:利用“守恒”三原则(即质量守恒、得失电子守恒、电荷守恒),逐项检查配平的方程式是否正确。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案