题目内容
【题目】常温下,将盐酸滴加到Na2X溶液中,混合溶液的pOH[pOH=—lgc(OH-)]与离子浓度变化的关系如图所示。
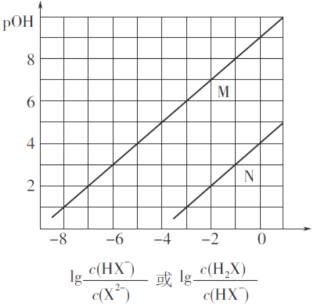
下列叙述正确的是
A. 曲线N表示pOH与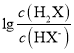 两者的变化关系
两者的变化关系
B. NaHX溶液中c(X2-)>c(H2X)
C. 当混合溶液呈中性时,c(Na+)=c(HX-)+2c(X2-)
D. 常温下,Na2X的第一步水解常数Kh1=1.0×10-4
【答案】D
【解析】
Na2X溶液中,X2-分步水解,以第一步水解为主,则Kh1(X2-)>Kh2(X2-),碱性条件下,则pOH相同时, >
>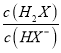 ,由图象可知N为pOH与lg
,由图象可知N为pOH与lg 的变化曲线,M为pOH与lg
的变化曲线,M为pOH与lg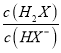 变化曲线,当lg
变化曲线,当lg 或lg
或lg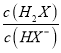 =0时,说明
=0时,说明 或
或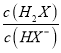 =1,浓度相等,结合图像可计算水解常数并判断溶液的酸碱性。
=1,浓度相等,结合图像可计算水解常数并判断溶液的酸碱性。
A.由以上分析可知,曲线N表示pOH与lg 的变化曲线,故A错误;B.由曲线M可知,当lg
的变化曲线,故A错误;B.由曲线M可知,当lg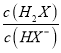 =0时,
=0时,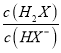 =1,pOH=9,c(OH-)=10-9mol/L,则Kh2(X2-)=
=1,pOH=9,c(OH-)=10-9mol/L,则Kh2(X2-)=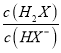 ×c(OH-)=1×10-9;由曲线N可知,当lg
×c(OH-)=1×10-9;由曲线N可知,当lg =0时,
=0时, =1,pOH=4,c(OH-)=10-4mol/L,Kh1(X2-)=
=1,pOH=4,c(OH-)=10-4mol/L,Kh1(X2-)= ×c(OH-)=1×10-4,则HX-的电离平衡常数Ka2=
×c(OH-)=1×10-4,则HX-的电离平衡常数Ka2=![]() =
=![]() =1×10-10,则NaHX溶液中HX-的水解程度大于电离程度,溶液中c(H2X)>c( X2-),故B错误;C.混合液中存在电荷守恒式为c(Na+)+ c(H+)=c(Cl-)+c(HX-)+2c(X2-)+c(OH-),则当混合溶液呈中性时,c(Na+)=c(Cl-)+c(HX-)+2c(X2-),故C错误;D.由曲线N可知,当lg
=1×10-10,则NaHX溶液中HX-的水解程度大于电离程度,溶液中c(H2X)>c( X2-),故B错误;C.混合液中存在电荷守恒式为c(Na+)+ c(H+)=c(Cl-)+c(HX-)+2c(X2-)+c(OH-),则当混合溶液呈中性时,c(Na+)=c(Cl-)+c(HX-)+2c(X2-),故C错误;D.由曲线N可知,当lg =0时,
=0时, =1,pOH=4,c(OH-)=10-4mol/L,则Kh1(X2-)=
=1,pOH=4,c(OH-)=10-4mol/L,则Kh1(X2-)= ×c(OH-)=1×10-4,故D正确;故答案为D。
×c(OH-)=1×10-4,故D正确;故答案为D。

 名校课堂系列答案
名校课堂系列答案【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:取等物质的量浓度等体积H2O2溶液分别进行下列实验,实验报告如下表所示。

序号 | 条件 | 现象 | 结论 | |
温度/℃ | 催化剂 | |||
1 | 40 | FeCl3溶液 | ||
2 | 20 | FeCl3溶液 | ||
3 | 20 | MnO2 | ||
4 | 20 | 无 | ||
(1)实验1、2的目的是研究__________因素对H2O2分解速率的影响。
(2)实验1对应的化学方程式为___________________________。
实验二:经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图所示的实验。可通过观察_________得出结论。 有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是____________________。
实验三:已知在高锰酸钾(KMnO4)酸性溶液和草酸(H2C2O4)溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显,但不久突然褪色,反应速率明显加快。
(1)写出硫酸酸化的高锰酸钾溶液和草酸溶液反应的化学方程式____________
(2)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是______。
(3)若用实验证明你的猜想/span>,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是__________。
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰
(4)若实验过程中将2.0mL0.10mol/LH2C2O4溶液与4.0mL0.010mol/L酸性KMnO4溶液混合(忽略溶液混合后体积的变化),测得溶液的褪色时间为40s,这段时间内平均反应速率v(KMnO4)=__________mol·L-1·min-1。

