题目内容
【题目】甲酸是基本有机化工原料之一,广泛用于农药、皮革、染料、医药和橡胶等工业。
(1)已知热化学反应方程式:
I:HCOOH(g)![]() CO(g)+H2O(g) △H1=+72.6kJmol-1;
CO(g)+H2O(g) △H1=+72.6kJmol-1;
II:2CO(g)+O2(g)![]() 2CO2(g) △H 2=-566.0kJmol-1;
2CO2(g) △H 2=-566.0kJmol-1;
III:2H2(g)+O2(g)![]() 2H2O(g) △H 3=-483.6kJmol-1
2H2O(g) △H 3=-483.6kJmol-1
则反应IV:CO2(g)+H2(g)![]() HCOOH(g)的△H =____________kJmol-1。
HCOOH(g)的△H =____________kJmol-1。
(2)查阅资料知在过渡金属催化剂存在下,CO2(g)和H2 (g)合成HCOOH(g)的反应分两步进行:第一步:CO2(g)+H2(g)+M(s)→MHCOOH(s);第二步:___________________。
①第一步反应的△H _________0(填“>”或“<”)。
②第二步反应的方程式为________________________。
③在起始温度、体积都相同的甲、乙两个密闭容器中分别投入完全相同的H2(g)和CO2(g),甲容器保持恒温恒容,乙容器保持绝热恒容,经测定,两个容器分别在t1、t2时刻恰好达到平衡,则t1_________t2(填“>”、“<”或“=”)。
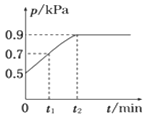
(3)在体积为1L的恒容密闭容器中,起始投料n(CO2)=1mol,以CO2(g)和H2(g)为原料合成HCOOH(g),HCOOH平衡时的体积分数随投料比[ ]的变化如图所示:
]的变化如图所示:

①图中T1、T2表示不同的反应温度,判断T1____________T2(填“〉”、“<”或“=” ) ,依据为____________________。
②图中a=______________。
③A、B、C三点CO2(g)的平衡转化率αA、αB、αC由大到小的顺序为____________。
④T1温度下,该反应的平衡常数K=______________(计算结果用分数表示)。
【答案】-31.4 < M·HCOOH(s)=HCOOH(g)+M(s) > < 该反应为放热反应,升高温度,平衡逆向移动,从图像中可知在相同投料比时,T1温度下产物的体积分数大于T2温度下产物的体积分数,则T1< T2; 1 ![]() >
>![]() >
>![]()
![]()
【解析】
(1)根据盖斯定律进行求算;
(2)①由△G=△H -T△S <0进行判断;
②总反应减去第一步反应可得第二步反应的方程式;
③甲容器恒温恒容,乙容器恒容绝热,由于该反应放热,所以乙容器的温度高于甲容器,所以乙容器反应速率较快,所以甲容器中反应达平衡所需时间比乙容器中的长;
(3)①该反应为放热反应,升高温度,平衡逆向移动;
②根据反应CO2(g)+H2(g)![]() HCOOH(g)及投料比[
HCOOH(g)及投料比[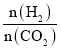 ]进行分析;
]进行分析;
③氢气的量越大,即投料比[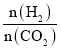 ]越大,CO2的转化率越大;
]越大,CO2的转化率越大;
④根据三段式进行计算。
(1)已知I:HCOOH(g)![]() CO(g)+H2O(g) △H1=+72.6kJmol-1;
CO(g)+H2O(g) △H1=+72.6kJmol-1;
II:2CO(g)+O2(g)![]() 2CO2(g) △H 2=-566.0kJmol-1;
2CO2(g) △H 2=-566.0kJmol-1;
III:2H2(g)+O2(g)![]() 2H2O(g) △H 3=-483.6kJmol-1
2H2O(g) △H 3=-483.6kJmol-1
根据盖斯定律,由III![]() -I- II
-I- II![]() 得反应IV:CO2(g)+H2(g)
得反应IV:CO2(g)+H2(g)![]() HCOOH(g) △H = (-483.6kJmol-1)
HCOOH(g) △H = (-483.6kJmol-1)![]() -72.6kJmol-1- (-566.0kJmol-1)
-72.6kJmol-1- (-566.0kJmol-1)![]() =-31.4kJmol-1;
=-31.4kJmol-1;
(2)①第一步反应CO2(g)+H2(g)+M(s)→MHCOOH(s)为熵减的反应,即△S<0,能自发进行,则△G=△H -T△S <0,故△H<0;
②CO2(g)和H2 (g)合成HCOOH(g)的总反应为CO2(g)+H2(g)![]() HCOOH(g);第一步:CO2(g)+H2(g)+M(s)=MHCOOH(s);总反应减去第一步反应可得第二步反应的方程式为M·HCOOH(s)=HCOOH(g)+M(s);
HCOOH(g);第一步:CO2(g)+H2(g)+M(s)=MHCOOH(s);总反应减去第一步反应可得第二步反应的方程式为M·HCOOH(s)=HCOOH(g)+M(s);
③甲容器恒温恒容,乙容器恒容绝热,由于该反应放热,所以乙容器的温度高于甲容器,所以乙容器反应速率较快,所以甲容器中反应达平衡所需时间比乙容器中的长,则t1>t2;
(3)①该反应为放热反应,升高温度,平衡逆向移动,从图像中可知在相同投料比时,T1温度下产物的体积分数大于T2温度下产物的体积分数,则T1< T2;
②根据反应CO2(g)+H2(g)![]() HCOOH(g),当投料比[
HCOOH(g),当投料比[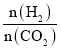 ]=1,即a=1时,恰好达到最大转化,HCOOH平衡时的体积分数最大;
]=1,即a=1时,恰好达到最大转化,HCOOH平衡时的体积分数最大;
③氢气的量越大,即投料比[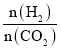 ]越大,CO2的转化率越大,故A、B、C三点CO2(g)的平衡转化率αA、αB、αC由大到小的顺序为
]越大,CO2的转化率越大,故A、B、C三点CO2(g)的平衡转化率αA、αB、αC由大到小的顺序为![]() >
>![]() >
>![]() ;
;
④T1温度下,在体积为1L的恒容密闭容器中,起始投料n(CO2)=1mol,C点时投料比[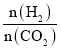 ]=2,则n(H2)=2mol,HCOOH平衡时的体积分数为5%,设平衡时CO2转化率为x,则:
]=2,则n(H2)=2mol,HCOOH平衡时的体积分数为5%,设平衡时CO2转化率为x,则:
CO2(g)+H2(g)![]() HCOOH(g)
HCOOH(g)
开始时的浓度(mol/L) 1 2 0
改变的浓度(mol/L) x x x
平衡时的浓度(mol/L)1-x 2-x x
则有![]() ,解得x=
,解得x=![]() ;该反应的平衡常数K=
;该反应的平衡常数K=![]() =
=![]() 。
。

【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10﹣5 | Ka1=4.3×10﹣7 Ka2=5.6×10﹣11 | Ka=3.0×10﹣8 |
(1)物质的量浓度均为0.1molL﹣1的四种溶液:pH由小到大排列的顺序是_______(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1molL﹣1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_____(填字母)_______
A. c(H+) B.![]() C. c(H+)c(OH﹣) D.
C. c(H+)c(OH﹣) D. ![]() E.
E. ![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:__________________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中
c(CH3COO﹣)﹣c(Na+)=________(填准确数值)。
(5)25℃时,将a molL﹣1的醋酸与b molL﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为____________________________________
(6)标准状况下,将1.12L CO2通入100mL 1molL﹣1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式: c(OH﹣)=2c(H2CO3)+_________________________