题目内容
1.现有500ml 1mol/L KCl 溶液,下列哪项的Cl-浓度与之相等( )| A. | 100ml 5mol/L KCl | B. | 250ml 5mol/L MgCl2 | ||
| C. | 100ml 1mol/L CaCl2 | D. | 250ml 1mol/L NaCl |
分析 500mL1mol/L的KCl溶液中的Cl-浓度为1mol/L,根据溶质化学式计算各选项中的Cl-物质的量,进行比较可知.注意溶液中溶质离子的浓度与溶液体积无关,只取决于物质电离出的离子的数目多少与溶质的浓度.
解答 解:500mL1mol/L的KCl溶液中的Cl-浓度为1mol/L.
A、100ml5mol/L的KCl溶液中Cl-浓度为5mol/L,与500mL1mol/L的KCl溶液中的Cl-浓度不相等,故A不符合;
B、250ml5mol/L的MgCl2溶液中Cl-浓度为10mol/L,与500mL1mol/L的KCl溶液中的Cl-浓度不相等,故B不符合;
C、100ml1mol/L的CaCl2溶液中Cl-浓度为2mol/L,与500mL1mol/L的KCl溶液中的Cl-浓度不相等,故C不符合;
D、250ml1mol/L的NaCl溶液中Cl-浓度为1mol/L,与500mL1mol/L的KCl溶液中的Cl-浓度相等,故D符合.
故选:D.
点评 本题考查物质的量浓度的计算与理解,题目难度不大,注意溶液中溶质离子的浓度与溶液体积无关,只取决于物质电离出的离子的数目多少与溶质的浓度.

练习册系列答案
相关题目
11.下列对相关概念的理解正确的是( )
| A. | 物质的量就是数量,只是描述对象为微观粒子 | |
| B. | 摩尔质量在数值上等于相对原子(或分子)质量,所以HCl的摩尔质量为36.5 | |
| C. | 阿伏伽德罗常数约为6.02×1023 | |
| D. | 物质的量是一个物理量,它将宏观的质量或体积与微观的粒子数联系起来 |
12.已知有热化学方程式:SO2(g)+1/2O2(g)=SO3(g);△H=-98.32kJ/mol.现有2molSO2参加反应,当放出137.5kJ热量时,SO2的转化率最接近于( )
| A. | 40% | B. | 50% | C. | 70% | D. | 90% |
9.下列反应中生成物的总能量大于反应物总能量的是( )
| A. | 稀硫酸与氢氧化钾溶液的反应 | B. | 氢气还原氧化铜的反应 | ||
| C. | 锌与稀硫酸的反应 | D. | 生石灰变成熟石灰的反应 |
16.下列物质的水溶液中,呈酸性的是( )
| A. | CO2 | B. | NaOH | C. | NaHCO3 | D. | K2SO4 |
6.下列混合物的分离方法不正确的是( )
| A. | 泥沙和食盐(溶解,过滤) | B. | 汽油和水(分液) | ||
| C. | KNO3和KCl(降温结晶) | D. | 酒精和水(分液) |
13.下列叙述正确的是( )
| A. | 25℃时,0.1mol•L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 | |
| B. | 某反应2A(g)?C(g)+3D(g)在高温时能自发进行,则该反应的△H<0 | |
| C. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| D. | 在轮船船体四周镶嵌锌块保护船体不受腐蚀的方法叫外加电流的阴极保护法 |
10.下列说法正确的是( )
| A. | 常温下,pH=3的HX(一元酸)溶液与pH=11的YOH(一元碱)溶液等体积混合,所得溶液的pH一定大于或等于7 | |
| B. | 在相同温度下,浓度均为0.1 mol•L-1的(NH4)2Fe(SO4)2和(NH4)2SO4溶液中,c(NH4+)相同 | |
| C. | 在pH<7的CH3COOH和CH3COONa的混合液中,c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 0.4 mol•L-1盐酸与0.1 mol•L-1NaAlO2溶液等体积混合,所得溶液中:c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-) |
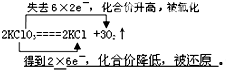 .
.