题目内容
19.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH下列叙述不正确的是( )| A. | 放电时每转移3mol电子,正极有1mol K2FeO4被氧化 | |
| B. | 充电时阳极反应为:2Fe(OH)3-6e-+10OH-═2FeO42-+8H2O | |
| C. | 放电时负极反应为:3Zn-6e-+6OH-═3Zn(OH)2 | |
| D. | 放电时正极附近溶液的碱性增强 |
分析 根据电池的总反应可知,高铁电池放电时必定是锌在负极失去电子,电极反应式为Zn-2e-+2OH-=Zn(OH)2,高铁酸钠在正极得到电子,电极反应式为FeO42+4H2O+3e-=Fe(OH)3+5OH-,生成氢氧根离子,碱性要增强,根据电极反应式可判断电子转移的物质的量与反应物之间的关系,充电时,阳极上氢氧化铁转化成高铁酸钠,电极反应式为Fe(OH)3+5OH-=FeO42+4H2O+3e-.
解答 解:A、放电时正极反应为FeO42+4H2O+3e-=Fe(OH)3+5OH-,每转移3mol电子,正极有1molK2FeO4被还原,故A错误;
B、充电时阳极发生Fe(OH)3失电子的氧化反应,即反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O,故B正确;
C、高铁电池放电时必定是锌在负极失去电子,电极反应式为Zn-2e-+2OH-=Zn(OH)2,故C正确;
D、放电时正极反应为FeO42+4H2O+3e-=Fe(OH)3+5OH-,生成氢氧根离子,碱性要增强,故D正确.
故选A.
点评 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力,增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
9.下列化学用语正确的是( )
| A. | CH4分子的比例模型: | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 甲醛分子的电子式: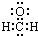 | D. | 基态硫原子的价电子排布:2s22p4 |
10.下列说法正确的是( )
| A. | HF比HCl稳定是由于HF分子间存在氢键所引起的 | |
| B. | 水在结冰时密度变小是由于水分子间存在氢键所引起的 | |
| C. | CH4分子很稳定,是由于分子间氢键的存在而导致的 | |
| D. | 离子化合物肯定含有金属元素,故在微粒间不存在共价键 |
7.下列有关实验操作和说法中,正确的是( )
| A. | 乙烷中混有乙烯,通过盛有酸性KMnO4溶液的洗气瓶洗气除去乙烯 | |
| B. | 检验C2H5Cl中氯原子时,将C2H5Cl和NaOH溶液混合加热后,加入稀硫酸酸化 | |
| C. | 用无水乙醇和浓H2SO4共热至140℃可以制得乙烯气体 | |
| D. | 制取溴苯应用液溴、铁屑和苯混合,反应后并用稀碱液洗涤 |
14.下列关于离子反应的说法中正确的是( )
| A. | 硫酸亚铁加过氧化氢溶液离子方程式为:Fe2++H2O2+2H+═Fe3++2H2O | |
| B. | 碘水中通入足量的SO2离子方程式为:I2+SO2+2H2O═2I-+SO42-+4H+ | |
| C. | 在碳酸氢钠溶液中:K+、Al3+、SO42-、Cl-可大量共存 | |
| D. | 使紫色石蕊试液呈红色的溶液中:Na+、K+、CO32-、NO3-可大量共存 |
4.利用表中的数据判断,V元素最有可能是下列元素中的( )
| A. | H | B. | Li | C. | Na | D. | K |
11.下列关于化学反应限度的叙述错误的是( )
| A. | 不同的化学反应,限度可能不同 | |
| B. | 可以通过改变反应物浓度来控制化学反应的限度 | |
| C. | 可以通过延长化学反应的时间来改变反应的限度 | |
| D. | 催化剂不能控制化学反应的限度 |
 (其中R为饱和烃基),在一定条件下发生如图所示转化关系:
(其中R为饱和烃基),在一定条件下发生如图所示转化关系:
 或
或 .
. .
.
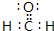 ,根据价层电子对互斥(VSEPR)理论推测该分子的空间构型为平面三角形.
,根据价层电子对互斥(VSEPR)理论推测该分子的空间构型为平面三角形.