题目内容
7.已知Zn(s)+$\frac{1}{2}$O2(g)=ZnO(s);△H=-350KJ/mol,则1g Zn在氧气中燃烧放出的热量约为( )| A. | 5.4KJ | B. | 350KJ | C. | 3.5KJ | D. | 8.5KJ |
分析 根据热化学方程式Zn(s)+$\frac{1}{2}$O2(g)═ZnO(s)△H=-350kJ/mol,说明1mol锌完全燃烧放出的热量为351kJ,由此计算1gZn在氧气中燃烧放出的热量.
解答 解:根据热化学方程式Zn(s)+$\frac{1}{2}$O2(g)═ZnO(s)△H=-351kJ/mol,说明1mol锌完全燃烧放出的热量为350KJ,则1gZn在氧气中燃烧放出的热量为$\frac{350kJ}{65}$≈5.4kJ,
故选A.
点评 本题考查热化学方程式的意义和计算,题目难度不大,注意热化学方程式的意义.

练习册系列答案
相关题目
18.下列表述正确的是( )
| A. | CH3F的电子式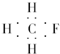 | B. | Na2S的电子式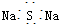 | C. | 氢氧根的电子式 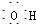 | D. | 次氯酸的电子式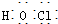 |
12.下列各组中的微粒均含有配位键的是( )
| A. | H2O、Al2Cl6 | B. | CO2、SO42- | ||
| C. | PCl5、[Co(NH3)4Cl2]Cl | D. | NH4Cl、[Cu(NH3)4]SO4 |
19.用乙炔为原料制取CH2BrCHBrCl,可行的反应途径是在一定条件下( )
| A. | 先与Cl2加成,再与Br2加成 | B. | 先与Cl2加成,再与HBr加成 | ||
| C. | 先与HCl加成,再与Br2加成 | D. | 先与HCl加成,再与HBr加成 |
16.下列关于浓硫酸和浓硝酸的说法正确的是( )
| A. | 浓硫酸和浓硝酸都能用来直接跟锌粒反应制氢气 | |
| B. | 浓硫酸和浓硝酸都能与单质碳反应 | |
| C. | 浓硫酸和浓硝酸加水稀释后都能与金属铜反应 | |
| D. | 浓硫酸和浓硝酸在常温下都能用金属铝制容器盛放 |
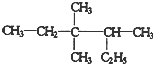 3,3,4-三甲基已烷
3,3,4-三甲基已烷 、
、 .
. ,则其分子式为C10H16,该烃的一溴取代物有2种.
,则其分子式为C10H16,该烃的一溴取代物有2种. .
.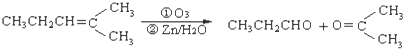 上述反应可用来推断烃分子中碳碳双键的位置.某烃A的分子式为C6H10,经过上述转化生成
上述反应可用来推断烃分子中碳碳双键的位置.某烃A的分子式为C6H10,经过上述转化生成 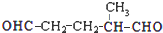 ,则烃A的结构可表示为
,则烃A的结构可表示为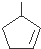 .
. W、X、Y、Z、M、G六种元素分属三个短周期,且原子序数依次增大.W、Z同主族,可形成离子化合物ZW;Y、M同主族,可形成MY2、MY3两种分子;X的气态氢化物水溶液呈碱性.请回答下列问题:
W、X、Y、Z、M、G六种元素分属三个短周期,且原子序数依次增大.W、Z同主族,可形成离子化合物ZW;Y、M同主族,可形成MY2、MY3两种分子;X的气态氢化物水溶液呈碱性.请回答下列问题: