题目内容
17.A、B、C、D、E、F六种短周期主族元素,原子序数依次增大.其中B元素原子的最外层电子数为电子层数的两倍;E是地壳中含量最高的金属元素;C、F同主族,C元素核电荷数只有F元素的一半;1mol D单质跟水反应放出11.2L(标准状况)A气体单质.请回答下列问题:(1)F在周期表中的位置是第3周期第VIA族
(2)C、D、F形成的某种常见化合物的晶体类型是离子晶体(填“晶体类型”名称)
(3)由A、C、D、F四种元素形成的两种化合物(均含四种元素)能发生化学反应生成一种气体,请写出该反应的离子方程式HSO3-+H+=H2O+SO2↑.
分析 A、B、C、D、E、F六种短周期主族元素,原子序数依次增大,E是地壳中含量最高的金属元素,则E是Al元素;C、F同主族,C元素核电荷数只有F元素的一半,二者原子序数相差8,则C是O、F是S元素;1mol D单质跟水反应放出11.2L(标准状况)A气体单质,且原子序数小于E而大于O元素,则D是Na元素、A是H元素;
B元素原子的最外层电子数为电子层数的两倍,且原子序数小于O元素,则B是C元素;
(1)主族元素原子核外电子层数等于其周期数,最外层电子数等于其族序数;
(2)C、D、F分别是O、Na、S元素,这三种元素形成的化合物是硫酸钠、亚硫酸钠,硫酸钠和亚硫酸钠都是由阴阳离子构成的;
(3)由H、O、Na、S四种元素形成的两种化合物(均含四种元素)能发生化学反应生成一种气体,这两种化合物分别是亚硫酸氢钠、硫酸氢钠,二者反应生成二氧化硫和水.
解答 解:A、B、C、D、E、F六种短周期主族元素,原子序数依次增大,E是地壳中含量最高的金属元素,则E是Al元素;C、F同主族,C元素核电荷数只有F元素的一半,二者原子序数相差8,则C是O、F是S元素;1mol D单质跟水反应放出11.2L(标准状况)A气体单质,且原子序数小于E而大于O元素,则D是Na元素、A是H元素;
B元素原子的最外层电子数为电子层数的两倍,且原子序数小于O元素,则B是C元素;
(1)F是S元素,S原子核外有3个电子层、最外层电子数是6,所以位于第三周期第VIA族,
故答案为:3;Ⅵ;
(2)C、D、F分别是O、Na、S元素,这三种元素形成的化合物是硫酸钠、亚硫酸钠,硫酸钠和亚硫酸钠都是由阴阳离子构成的,所以属于离子晶体,故答案为:离子晶体;
(3)由H、O、Na、S四种元素形成的两种化合物(均含四种元素)能发生化学反应生成一种气体,这两种化合物分别是亚硫酸氢钠、硫酸氢钠,二者反应生成二氧化硫和水,离子方程式为HSO3-+H+=H2O+SO2↑,
故答案为:HSO3-+H+=H2O+SO2↑.
点评 本题考查位置结构性质相互关系及应用,涉及离子方程式的书写、晶体类型判断、元素在周期表中的位置等知识点,正确判断元素是解本题关键,注意离子方程式书写规则,为易错点.

 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案| A. | 5.4KJ | B. | 350KJ | C. | 3.5KJ | D. | 8.5KJ |
| A. | 标准状况下,22.4L辛烷的分子数为NA | |
| B. | 1 mol甲基(-CH3)所含的电子总数为9NA | |
| C. | 0.5 mol 1,3-丁二烯分子中含有C=C双键数为 NA | |
| D. | 28gC2H4所含共用电子对数目为6NA |
| A. | 只有4种 | B. | 只有3种 | C. | 只有2种 | D. | 只有1种 |
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl是取代反应 | |
| B. | CH2=CH2+Br2→CH2Br-CH2Br是加成反应 | |
| C. | 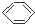 +HO-NO2$→_{60℃}^{浓硫酸}$ +HO-NO2$→_{60℃}^{浓硫酸}$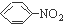 +H2O是取代反应 +H2O是取代反应 | |
| D. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O是加成反应 |
| A. | 盐酸 | B. | 钠 | C. | 溴水 | D. | FeCl3溶液 |
| A. | 1.6 mol | B. | 2.8 mol | C. | 3.2 mol | D. | 3.6 mol |
| A. | 硬铝 | B. | 青铜 | C. | 水银 | D. | 钢 |
| A. | 2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O | |
| B. | CaO+H2O=Ca(OH)2 | |
| C. | CaCO3 $\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑ | |
| D. | CH3CH2OH(酒精)+3O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2+3 H2O |