题目内容
【题目】某化学兴趣小组同学设计实验制备亚氯酸钠![]() 并对其性质进行研究。
并对其性质进行研究。
实验Ⅰ:制取![]()
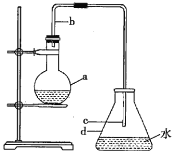
利用如图所示装置进行实验。

![]() 仪器a的名称是________,其作用是________。
仪器a的名称是________,其作用是________。
![]() 装置
装置![]() 发生的反应中氧化剂和还原剂的物质的量之比为________。
发生的反应中氧化剂和还原剂的物质的量之比为________。
![]() 装置
装置![]() 中制备
中制备![]() 的离子方程式为________。
的离子方程式为________。
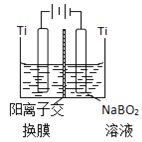
![]() 用电解
用电解![]() 和
和![]() 的混合溶液也可以制备
的混合溶液也可以制备![]() ,阴极的电极反应式为________。
,阴极的电极反应式为________。
实验Ⅱ:研究![]() 的性质
的性质
![]() 利用所提供的试剂
利用所提供的试剂![]() 样品、
样品、![]() 溶液、KI溶液、稀硫酸、稀硝酸
溶液、KI溶液、稀硫酸、稀硝酸![]() 验证
验证![]() 的氧化性,并测定
的氧化性,并测定![]() 样品的纯度。
样品的纯度。
![]() 准确称取所得
准确称取所得![]() 样品
样品![]() 于烧杯中,加入适量蒸馏水和过量的________,再滴入适量的________,充分反应,反应的离子方程式为________。将所得混合液配成
于烧杯中,加入适量蒸馏水和过量的________,再滴入适量的________,充分反应,反应的离子方程式为________。将所得混合液配成![]() 待测溶液。
待测溶液。
![]() 移取
移取![]() 待测溶液于锥形瓶中,加几滴淀粉溶液,用
待测溶液于锥形瓶中,加几滴淀粉溶液,用![]() 标准液滴定,至滴定终点。重复2次,测得消耗标准液的平均体积为
标准液滴定,至滴定终点。重复2次,测得消耗标准液的平均体积为![]() 已知:
已知:![]() 。该样品中
。该样品中![]() 的质量分数为________
的质量分数为________![]() 保留一位小数
保留一位小数![]() 。
。
【答案】干燥管 防止倒吸 ![]()
![]()
![]()
![]() 溶液 稀硫酸
溶液 稀硫酸 ![]()
![]() 。
。
【解析】
⑴看图得出仪器a的名称,其作用是防止倒吸。
⑵在酸性条件下,![]() 被
被![]() 还原为
还原为![]() ,化合价降低1价,
,化合价降低1价,![]() 被
被![]() 氧化为
氧化为![]() ,化合价升高2价。
,化合价升高2价。
⑶在碱性条件下,![]() 被
被![]() 还原为
还原为![]() ,
,![]() 被
被![]() 氧化为
氧化为![]() ,得出离子方程式。
,得出离子方程式。
⑷电解时,![]() 在阴极得到电子生成
在阴极得到电子生成![]() ,写出电极反应式。
,写出电极反应式。
⑸①根据题意知:准确称取所得![]() 样品
样品![]() 于烧杯中,加入适量蒸馏水和过量的KI溶液,再滴入适量的稀硫酸,写出反应的离子方程式。
于烧杯中,加入适量蒸馏水和过量的KI溶液,再滴入适量的稀硫酸,写出反应的离子方程式。
![]() 根据方程式建立关系式,再建立等式进行计算。
根据方程式建立关系式,再建立等式进行计算。
⑴仪器a的名称是干燥管,作用是防止倒吸,故答案为:干燥管;防止倒吸;
⑵在酸性条件下,![]() 被
被![]() 还原为
还原为![]() ,化合价降低1价,
,化合价降低1价,![]() 被
被![]() 氧化为
氧化为![]() ,化合价升高2价,故装置
,化合价升高2价,故装置![]() 中氧化剂和还原剂的物质的量之比为
中氧化剂和还原剂的物质的量之比为![]() ,故答案为:
,故答案为:![]() 。
。
⑶在碱性条件下,![]() 被
被![]() 还原为
还原为![]() ,
,![]() 被
被![]() 氧化为
氧化为![]() ,装置
,装置![]() 中制备
中制备![]() 的离子方程式为
的离子方程式为![]() ,故答案为:
,故答案为:![]() 。
。
⑷电解时,![]() 在阴极得到电子生成
在阴极得到电子生成![]() ,其电极反应式为
,其电极反应式为![]() ,故答案为:
,故答案为:![]() 。
。
⑸①根据题意知:准确称取所得![]() 样品
样品![]() 于烧杯中,加入适量蒸馏水和过量的KI溶液,再滴入适量的稀硫酸,充分反应,反应的离子方程式为
于烧杯中,加入适量蒸馏水和过量的KI溶液,再滴入适量的稀硫酸,充分反应,反应的离子方程式为![]() ,故答案为:KI溶液;稀硫酸;
,故答案为:KI溶液;稀硫酸;![]() 。
。
![]() 根据方程式
根据方程式![]() 、
、![]() ,
,
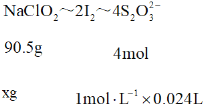
90.5g:xg = 4mol: ![]()
解得x = 0.543g,所以样品中![]() 的质量分数为
的质量分数为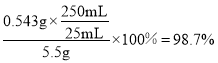 ,故答案为:
,故答案为:![]() 。
。

【题目】往2L密闭容器中充入NO2,在三种不同条件下发生反应:2NO2(g)2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表![]() 不考虑生成N2O4)
不考虑生成N2O4)
0 | 10 | 20 | 30 | 40 | 50 | |
实验1/800 | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
实验2/800 | 1.00 | 0.70 | 0.50 | 0.50 | 0.50 | 0.50 |
实验3/850 | 1.00 | 0.50 | 0.40 | 0.15 | 0.15 | 0.15 |
下列说法正确的是( )
A.实验2比实验1的反应容器内压强减小
B.实验2比实验l使用了效率更高的催化剂
C.实验1比实验3的平衡常数大
D.实验2和实验3可判断该反应是放热反应