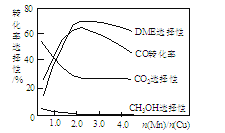
题目内容
【题目】过碳酸钠![]() 常作除污剂、清洗剂和杀菌剂。市售过碳酸钠样品一般含有碳酸钠,为了测定某过碳酸钠样品
常作除污剂、清洗剂和杀菌剂。市售过碳酸钠样品一般含有碳酸钠,为了测定某过碳酸钠样品![]() 只含
只含![]() 和
和![]() 的纯度,某小组设计如下两种实验方案:
的纯度,某小组设计如下两种实验方案:
实验原理:![]() 也可以用盐酸与过碳酸钠反应
也可以用盐酸与过碳酸钠反应![]() 。
。
方案1:液吸法。取![]() 样品于烧瓶中,加入足量的稀硫酸,实验装置如图所示。已知:在分析化学中,常用醋酸亚铬
样品于烧瓶中,加入足量的稀硫酸,实验装置如图所示。已知:在分析化学中,常用醋酸亚铬![]() 溶液作
溶液作![]() 的吸收剂。
的吸收剂。
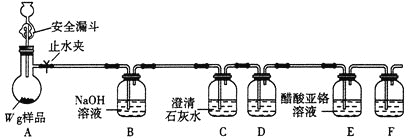
⑴安全漏斗中“安全”的含义是____________________________。
⑵装置C的作用是__________;装置D和F盛放同一种试剂,可能是________(填名称)。
⑶本实验通过装置________________(填字母)实验前后质量差可测定![]() 的质量。
的质量。
⑷实验装置气密性良好及装置内试剂足量,但实验发现测定的样品纯度总是偏低,其主要原因可能是________________________。
方案2:量气法。实验装置如图所示。
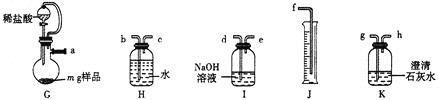
⑸气流方向由左至右,则导管口连接顺序为![]() ________
________![]() 。
。
⑹实验时向烧瓶内加入足量稀盐酸,实验完毕后,在室温下,测得J中水的体积为![]() 。已知室温下,气体摩尔体积为
。已知室温下,气体摩尔体积为![]() 。该样品纯度为__________%(用含x、y、m的代数式表示)。若其他操作都合理,读数时J中液面高于H中液面,则测得结果________(填“偏高”“偏低”或“无影响”)。
。该样品纯度为__________%(用含x、y、m的代数式表示)。若其他操作都合理,读数时J中液面高于H中液面,则测得结果________(填“偏高”“偏低”或“无影响”)。
【答案】残留在漏斗内液体起液封作用 检验![]() 是否除尽 浓硫酸
是否除尽 浓硫酸 ![]() 装置内残留有
装置内残留有![]()
![]()
![]() 偏低
偏低
【解析】
⑴中间残留在漏斗内液体起液封作用。
⑵澄清的石灰水是检验二氧碳气体的;E装置中醋酸亚铬是吸收氧气,D和F作用防止水蒸气进入E。
⑶E装置中醋酸亚铬是吸收氧气。
⑷装置内残留有![]() 可能影响实验测定的样品纯度。
可能影响实验测定的样品纯度。
⑸H和J组合是测定氧气体积,I装置是吸收二氧化碳,K装置是验证二氧化气体是否被完全吸收。
⑹通过计算得到纯度;若其他操作都合理,读数时J中液面高于H中液面,导致测量氧气体积偏小。
⑴安全漏斗中“安全”的含义是:残留在漏斗内液体起液封作用;故答案为:残留在漏斗内液体起液封作用。
⑵澄清的石灰水是检验二氧碳气体的,C装置的作用是检验![]() 是否除尽;E装置中醋酸亚铬是吸收氧气,D和F作用防止水蒸气进入E,因此装置D和F盛放同一种试剂,可能是浓硫酸;故答案为:检验
是否除尽;E装置中醋酸亚铬是吸收氧气,D和F作用防止水蒸气进入E,因此装置D和F盛放同一种试剂,可能是浓硫酸;故答案为:检验![]() 是否除尽;浓硫酸。
是否除尽;浓硫酸。
⑶E装置中醋酸亚铬是吸收氧气,并通过实验前后质量差可测定![]() 的质量;故答案为:E。
的质量;故答案为:E。
⑷实验装置气密性良好及装置内试剂足量,但实验发现测定的样品纯度总是偏低,其主要原因可能是装置内残留有![]() ;故答案为:装置内残留有
;故答案为:装置内残留有![]() 。
。
⑸H和J组合是测定氧气体积,I装置是吸收二氧化碳,K装置是验证二氧化气体是否被完全吸收,故管口连接顺序为![]() ;故答案为:
;故答案为:![]() 。
。
⑹该样品纯度为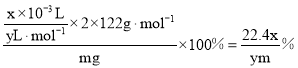 ;若其他操作都合理,读数时J中液面高于H中液面,导致测量氧气体积偏小,则测得结果偏低;故答案为:
;若其他操作都合理,读数时J中液面高于H中液面,导致测量氧气体积偏小,则测得结果偏低;故答案为:![]() ;偏低。
;偏低。

 53随堂测系列答案
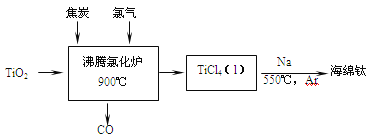
53随堂测系列答案【题目】TiCl4是制备钛及其化合物的重要中间体,可利用下列装置在实验室制备TiCl4(夹持装置略去): TiO2+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
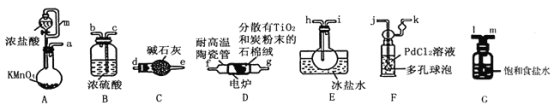
已知:①PdCl2溶液捕获CO时生成Pd单质;②相关数据如下表:
化合物 | 熔点/℃ | 沸点/℃ | 密度/gcm-3 | 溶解性 |
TiCl4 | -25 | 136 | 1.5 | 能溶于有机溶剂:遇水分解生成难溶于水的物质 |
CCl4 | -23 | 76.8 | 1.6 | 难溶于水 |
回答下列问题:
(1)装置A中连通管的作用是______;装置E中使用冰盐水浴的目的是_____________________。
(2)按照气流由左到右的方向,上述装置合理的连接顺序为____________________ (填仪器接口字母);根据完整的实验装置进行实验,实验步骤如下:_____________; 装入药品;向装置A烧瓶中滴加适量浓盐酸,当观察到_________时,加热装置D中陶瓷管;装置E烧瓶中的液体量不再增加时,停止加热,充分冷却。
(3)装置C的作用为___________________。
(4)装置F中发生反应的化学方程式为________________________。
(5)制得的TiCl4中常含有少量CCl4, 从混合液体中分离出TiCl4的操作名称为_______________。
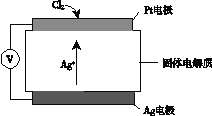
(6)利用如图所示装置测定产品纯度:称取w g TiCl4产品进行实验,向安全漏斗中加入适量蒸馏水,待四氯化钛充分反应后,将烧瓶和安全漏斗中的液体一并转入锥形瓶中,用氢氧化钠溶液调节至中性,滴加几滴0.1 molL-1的K2CrO4溶液作指示剂,用cmol L-1 AgNO3标准溶液滴定至终点( Ag2CrO4为红棕色沉淀,可指示滴定终点),重复滴定两次,平均消耗标准溶液V mL。
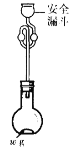
已知:TiCl4 +(2+x)H2O=TiO2xH2O↓+4HCl
①安全漏斗在本实验中的作用除加水外,还有___________。
②根据上述数据计算该产品的纯度为__________。(用含w、c和V的代数式表示)
【题目】某学习小组利用二氧化氯![]() 制备消毒剂、漂白剂亚氯酸钠
制备消毒剂、漂白剂亚氯酸钠![]() ,有关反应原理:
,有关反应原理:![]() 放热反应
放热反应![]()
实验一、制备![]() 晶体
晶体
选择如图所示装置设计实验制备亚氯酸钠晶体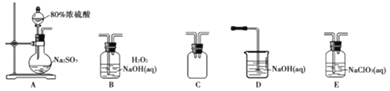
已知:饱和![]() 溶液析出晶体与度关系如下表所示:
溶液析出晶体与度关系如下表所示:
温度 |
|
|
|
品体成分 |
|
|
|
⑴装置连接顺序:![]() ______
______
⑵C装置的作用是______D装置作用是______
⑶A装置中选择![]() 浓硫酸的理由是______
浓硫酸的理由是______
⑷写出E装置中发生反应的离子方程式______
⑸对B装置中溶液采用结晶法提取无水亚氯酸钠晶体,操作分别为蒸发结晶、趁热过滤、用![]() 左右热水洗涤、低于
左右热水洗涤、低于![]() 条件下干燥,得到成品,蒸发结晶时控制温度为______
条件下干燥,得到成品,蒸发结晶时控制温度为______
实验二、测定产品纯度
⑹准确称量/span>ag产品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生反应:![]() ,将所得混合溶液稀释成250mL待测液。取
,将所得混合溶液稀释成250mL待测液。取![]() 待测液于锥形瓶,加入淀粉溶液作指示剂,用
待测液于锥形瓶,加入淀粉溶液作指示剂,用![]() 标准
标准![]() 溶液滴定至终点,测得消耗
溶液滴定至终点,测得消耗![]() 标准溶液的体积为
标准溶液的体积为![]() (已知:
(已知:![]() )
)
![]() 该产品纯度为______(只要求列出计算式)
该产品纯度为______(只要求列出计算式)
![]() 若滴定前滴定管尖嘴有气泡,滴定终点时尖嘴气泡消失,则测得结果______(填“偏高偏低”或“无影响”)
若滴定前滴定管尖嘴有气泡,滴定终点时尖嘴气泡消失,则测得结果______(填“偏高偏低”或“无影响”)