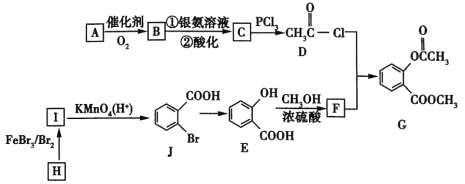
题目内容
【题目】已知:Ag++SCN-=AgSCN↓(白色)。实验室可通过如下过程测定所制硝酸银样品的纯度(杂质不参与反应)。
(1)称取2.000g制备的硝酸银样品,加水溶解,定容到100 mL。溶液配制过程中所用的玻璃仪器除烧杯、玻璃棒外还有_________。
(2)准确量取25.00 mL溶液,酸化后滴入几滴铁铵钒[NH4Fe(SO4)2]溶液作指示剂,再用0.100 mol·L-1 NH4SCN标准溶液滴定。滴定终点的实验现象为_________。终点时消耗标准溶液25mL,硝酸银样品纯度为_________。
【答案】100mL容量瓶、胶头滴管、(量筒) 溶液变为红色且半分钟内不褪色 85%
【解析】
(1)配制100 mL 一定物质的量浓度的溶液,所需要的玻璃仪器有烧杯、玻璃棒、100mL容量瓶、胶头滴管,可能还用到量筒;
(2)用NH4SCN标准溶液滴定硝酸银溶液,滴定终点时,SCN-与铁离子结合生成血红色溶液,据此分析;终点时消耗标准溶液25mL,则NH4SCN的物质的量为0.1000molL-1×0.025L=2.5×10-3mol,根据Ag++SCN-=AgSCN↓可求得硝酸银的质量,进而确定硝酸银样品纯度;
(1)配制100mL一定物质的量浓度的溶液,所需要的玻璃离仪器有烧杯、玻璃棒、100mL容量瓶、胶头滴管,可能还用到量筒;
故答案为:100mL容量瓶、胶头滴管、(量筒);
(2)用NH4SCN标准溶液滴定硝酸银溶液,滴定终点时,SCN与铁离子结合生成血红色溶液,所以滴定终点的实验现象为溶液变为(血)红色,且半分钟内不褪色;终点时消耗标准溶液25mL,则NH4SCN的物质的量为0.1000molL-1×0.025L=2.5×10-3mol,根据Ag++SCN-=AgSCN↓可知硝酸银的质量为2.5×10-3mol×170g/mol×![]() =1.70g,所以硝酸银样品纯度为
=1.70g,所以硝酸银样品纯度为![]() ,
,
故答案为:溶液变为红色且半分钟内不褪色;85%。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案【题目】TiCl4是制备钛及其化合物的重要中间体,可利用下列装置在实验室制备TiCl4(夹持装置略去): TiO2+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
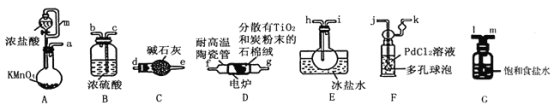
已知:①PdCl2溶液捕获CO时生成Pd单质;②相关数据如下表:
化合物 | 熔点/℃ | 沸点/℃ | 密度/gcm-3 | 溶解性 |
TiCl4 | -25 | 136 | 1.5 | 能溶于有机溶剂:遇水分解生成难溶于水的物质 |
CCl4 | -23 | 76.8 | 1.6 | 难溶于水 |
回答下列问题:
(1)装置A中连通管的作用是______;装置E中使用冰盐水浴的目的是_____________________。
(2)按照气流由左到右的方向,上述装置合理的连接顺序为____________________ (填仪器接口字母);根据完整的实验装置进行实验,实验步骤如下:_____________; 装入药品;向装置A烧瓶中滴加适量浓盐酸,当观察到_________时,加热装置D中陶瓷管;装置E烧瓶中的液体量不再增加时,停止加热,充分冷却。
(3)装置C的作用为___________________。
(4)装置F中发生反应的化学方程式为________________________。
(5)制得的TiCl4中常含有少量CCl4, 从混合液体中分离出TiCl4的操作名称为_______________。
(6)利用如图所示装置测定产品纯度:称取w g TiCl4产品进行实验,向安全漏斗中加入适量蒸馏水,待四氯化钛充分反应后,将烧瓶和安全漏斗中的液体一并转入锥形瓶中,用氢氧化钠溶液调节至中性,滴加几滴0.1 molL-1的K2CrO4溶液作指示剂,用cmol L-1 AgNO3标准溶液滴定至终点( Ag2CrO4为红棕色沉淀,可指示滴定终点),重复滴定两次,平均消耗标准溶液V mL。
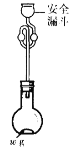
已知:TiCl4 +(2+x)H2O=TiO2xH2O↓+4HCl
①安全漏斗在本实验中的作用除加水外,还有___________。
②根据上述数据计算该产品的纯度为__________。(用含w、c和V的代数式表示)