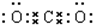题目内容
13.纳米级四氧化三铁是应用最为广泛的软磁性材料之一,常用作记录材料,磁流体材料,催化剂,电子材料等.其在生物技术领域和医学领域也有很好的应用前景.共沉淀法是目前制备纳米四氧化三铁的重要方法,其流程如图示: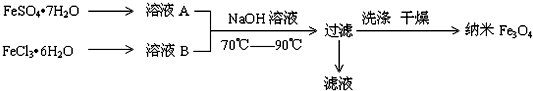
请回答下列问题:(1)实验室保存溶液A时,需加入铁粉、硫酸.
(2)为了得到较纯的纳米Fe3O4,FeSO4•7H2O 和 FeCl3•6H2O的物质的量之比最好应为1:2,在此条件下,检验铁元素是否沉淀完全的实验操作是取少量上层清液,加入KSCN溶液,若溶液不变红色证明铁元素沉淀完全.
(3)写出制备纳米Fe3O4的离子反应方程式Fe2++2Fe3++8OH-=Fe3O4+4H2O.
(4)共沉淀法的主要不足是:①得到的Fe3O4纳米粒子间存在团聚现象②Fe2+易被氧化为Fe3+,很难控制FeSO4•7H2O和FeCl3•6H2O的物质的量之比为1:2,产品含有杂质.
(5)磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性,下列关于纳米Fe3O4磁硫体的说法中不正确的是:A.
A、纳米Fe3O4磁硫体分散系属于溶液.
B、纳米Fe3O4磁硫体可以通过渗析法得到提纯.
C、当一束可见光通过该磁硫体时会出现光亮的通路.
D、纳米Fe3O4磁硫体比较稳定.
分析 硫酸亚铁晶体溶解得到溶液A,氯化铁晶体溶解得到溶液B,二者混合加入氢氧化钠溶液加热发生反应Fe2++2Fe3++8OH-=Fe3O4+4H2O,过滤得到纳米级四氧化三铁,
(1)硫酸亚铁易被氧化为硫酸铁,硫酸亚铁为强酸弱碱盐,易发生水解;
(2)FeSO4•7H2O和FeCl3•6H2O在氢氧化钠溶液中生成四氧化三铁、水、氯化钠;根据电荷守恒可写出该方程式,根据方程式求解理论上FeSO4•7H2O和FeCl3•6H2O的物质的量之比;铁元素沉淀完全的实验设计应依据铁离子的检验方法设计,铁离子遇到硫氰酸钾溶液变红色;
(3)FeSO4•7H2O和FeCl3•6H2O在氢氧化钠溶液中生成四氧化三铁、水、氯化钠;根据电荷守恒可写出该反应的离子方程式;
(4)共沉淀法制备纳米级Fe3O4的关键为FeSO4•7H2O和FeCl3•6H2O的物质的量之比为1:2,Fe2+易被氧化为Fe3+,产品有杂质;
(5)根据题意磁流体分散系分散质粒子直径在10纳米以下,属于胶体的范畴,所以应具备胶体的性质,根据胶体的性质分析.
解答 解:(1)硫酸亚铁易被氧化为硫酸铁,常加入少量铁粉防止亚铁离子被氧化,加入硫酸防止其水解,
故答案为:铁粉、硫酸;
(2)生成Fe3O4的反应物为Fe2+、Fe3+和OH-,根据电荷守恒可写出该离子方程式为Fe2++2Fe3++8OH-=Fe3O4+4H2O,化学方程式为FeSO4•7H2O+2FeCl3•6H2O+8NaOH=Fe3O4↓+17H2O+Na2SO4+6NaCl,FeSO4•7H2O和FeCl3•6H2O的物质的量之比为1:2,在此条件下,检验铁元素是否沉淀完全的实验操作是取少量上层清液,加入KSCN溶液,若溶液不变红色证明铁元素沉淀完全,
故答案为:1:2,取少量上层清液,加入KSCN溶液,若溶液不变红色证明铁元素沉淀完全;
(3)制备纳米Fe3O4的离子反应方程式为:Fe2++2Fe3++8OH-=Fe3O4+4H2O,
故答案为:Fe2++2Fe3++8OH-=Fe3O4+4H2O;
(4)共沉淀法制备纳米级Fe3O4的反应为FeSO4•7H2O+2FeCl3•6H2O+8NaOH=Fe3O4↓+17H2O+Na2SO4+6NaCl,Fe2+易被氧化为Fe3+,无法控制FeSO4•7H2O和FeCl3•6H2O的物质的量之比为1:2,产品有杂质,
故答案为:Fe2+易被氧化为Fe3+,很难控制FeSO4•7H2O和FeCl3•6H2O的物质的量之比为1:2,产品含有杂质;
(5)根据题意磁流体分散系分散质粒子直径在10纳米以下,属于胶体的范畴,具备胶体的性质.
A.分散质粒子直径在10纳米以下,所得分散系为胶体,所以不是溶液,故A错误;
B.该分散性属于胶体,胶体可以通过渗析法得到提纯,故B正确;
C.该分散性属于胶体,胶体有丁达尔效应,所以当一束强光通过此磁流体时会出现光亮的通路,故C正确;
D.所得分散系为胶体,较稳定,属于介稳体系,故D正确;
故答案为:A.
点评 本题考查含氮、铁化合物的性质以及氧化还原反应,题目难度中等,注意从化合价变化的角度分析氧化还原反应的有关概念和计算,注意把握题给信息,为解答该题的关键.

 快捷英语周周练系列答案
快捷英语周周练系列答案| A. | 2gH2含有的氢原子数目为NA | |
| B. | 常温下,1molCl2与足量NaOH溶液完全反应,转移的电子数为2NA | |
| C. | 常温常压下,11.2L氧气含有的原子数目为NA | |
| D. | 1L1 mol•L-1 KOH溶液中含有的钾离子数目为NA |
| 活性炭 | NO | E | F | |
| 初始时(mol) | 2.050 | 0.200 | 0 | 0 |
| 平衡时(mol) | 2.000 | 0.100 | 0.050 | 0.050 |
| A. | 该反应的平衡常数为$\frac{1}{4}$ | |
| B. | 增加活性炭的量,能缩短达到平衡所用的时间 | |
| C. | 容器中压强不变可以说明该反应达到平衡状态 | |
| D. | 达到平衡时,用E表示该反应的速率为0.01 mol•L-1•min-1 |
2A(g)+B(g)?2C(g),若经 2s(秒)后测得C的浓度为0.6mol•L-1,现有下列几种说法,其中正确的是( )
| A. | 用物质 A 表示的反应的平均速率为 0.3 mol•L-1•s-1 | |
| B. | 用物质 B 表示的反应的平均速率为 0.6 mol•L-1•s-1 | |
| C. | 2 s 时物质 A的转化率为70% | |
| D. | 2 s 时物质 B的浓度为 0.7 mol•L-1 |
 某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则
某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则