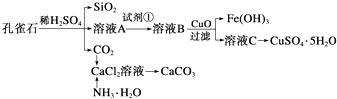
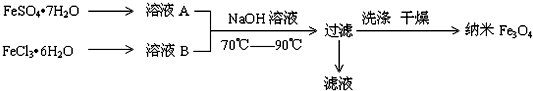
题目内容
5.恒压(1.01×105 Pa)下,将2.0mol SO2与 a mol O2的混合气体通入一个容积可变的密闭容器中,发生如下反应:2SO2 (g)+O2(g)?2SO3(g),△H<0
(1)T1℃下反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol,则a=3.65;平衡时SO2 的转化率为65%.
(2)T2℃下反应达平衡时,混合气体的物质的量共为4.8mol.T1与T2的关系是①(选填序号).
①T1>T2 ②T1<T2 ③T1=T2.
分析 (1)T1℃下反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol,则:
2SO2 (g)+O2(g)?2SO3(g)
起始量(mol):2 a 0
转化量(mol):1.3 0.65 1.3
平衡量(mol):0.7 3 1.3
氧气平衡物质的量=氧气起始物质的量-氧气物质的量变化量,平衡时SO2 的转化率=$\frac{消耗二氧化硫物质的量}{二氧化硫起始物质的量}$×100%;
(2)T1℃下反应达平衡时,混合气体总物质的量为5mol,T2℃下反应达平衡时,混合气体的物质的量共为4.8mol,与T1℃下反应达平衡相比平衡正向移动,正反应为放热反应,降低温度平衡正向移动.
解答 解:(1)T1℃下反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol,则:
2SO2 (g)+O2(g)?2SO3(g)
起始量(mol):2 a 0
转化量(mol):1.3 0.65 1.3
平衡量(mol):0.7 3 1.3
则a=3+0.65=3.65,平衡时SO2 的转化率=$\frac{1.3mol}{2mol}$×100%=65%,
故答案为:3.65;65%;
(2)T1℃下反应达平衡时,混合气体总物质的量为5mol,T2℃下反应达平衡时,混合气体的物质的量共为4.8mol,与T1℃下反应达平衡相比平衡正向移动,正反应为放热反应,降低温度平衡正向移动,故温度T1>T2,
故选:①.
点评 本题考查化学平衡计算与影响因素,难度不大,注意三段式解题法在化学平衡计算中应用.

| 化学键 | N≡N | H-H | N-H |
| 键能/kJ•mol-1 | a | b | c |
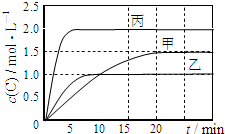 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以如表和如图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以如表和如图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
| A. | x=1 | |
| B. | 10min内乙容器中反应的平均速率v(B)=0.025mol•L-1•min-1 | |
| C. | 由图可知:T1<T2,且该反应为吸热反应 | |
| D. | T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为75% |
①加大盐酸用量 ②增大盐酸浓度 ③粉碎石灰石 ④增大体系压强.
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ③④ |
 室温下,在0.2mol•L-1 Al2(SO4)3溶液中,逐滴加入1.0mol•L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法错误的是( )
室温下,在0.2mol•L-1 Al2(SO4)3溶液中,逐滴加入1.0mol•L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法错误的是( )| A. | a点时,溶液呈酸性的原因是:Al3++3H2O?Al(OH)3↓+3H+ | |
| B. | b~c段,加入的NaOH主要用于生成Al(OH)3沉淀 | |
| C. | c′~d段,溶液显碱性的原因是:NaOH═Na++OH- | |
| D. | d~e段,发生的反应为:Al(OH)3+NaOH═NaAlO2+2H2O |
| A. | 表面富有光泽 | B. | 有可成键的电子 | ||
| C. | 有金属离子 | D. | 有自由运动的电子 |
| A. | 某溶液中溶质的质量分数超过100% | B. | 某常见气体的密度为1.8g/cm3 | ||
| C. | 用10ml量筒量取5.23ml浓硫酸 | D. | 用托盘天平称得氯化钠 5.0g |