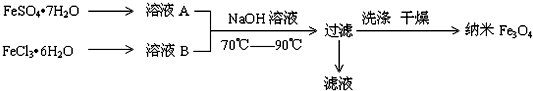
题目内容
2.请回答:(1)CO2的电子式
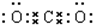
(2)将硫化钠溶液与氯化铝溶液混合,有白色沉淀和气体生成,但此沉淀不是硫化铝.写出该反应的离子反应方程式:2Al3++3S2-+6H2O═2Al(OH)3↓+3H2S↑
(3)将NH3通过灼热的CuO,有无色无味的难溶于水的气体生成,写出该反应的化学方程式:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O.
(4)CoCl2常用作多彩水泥的添加剂,可用钴的某种氧化物与盐酸反应制备(其中Co的化合价为+2、+3).现取适量这种钴的氧化物,可与480mL 5mol•L-1盐酸恰好完全反应,得到CoCl2溶液和6.72L黄绿色气体(标准状况).则该反应的化学反应方程式为Co3O4+8HCl═3CoCl2+Cl2+4H2O.
分析 (1)二氧化碳是共价化合物,碳原子和氧原子间形成共价键,二氧化碳中存在两个碳氧双键,标注原子最外层电子写出电子式;
(2)将硫化钠溶液与氯化铝溶液混合,有白色沉淀和气体生成是发生了双水解反应生成氢氧化铝沉淀和硫化氢气体;
(3)将NH3通过灼热的CuO,有无色无味的难溶于水的气体生成,是氨气的还原性被氧化铜氧化生成氮气和水;
(4)由电子守恒:n(Co3+)=2 n(Cl2),由电荷守恒:n(Co原子)总=n(Co2+)溶液=$\frac{1}{2}$n(Cl-),联立计算n氧化物(Co2+),根据化合价电荷守恒为0计算氧化物中n(O),进而计算氧化物中n(Co):n(O),结合原子守恒写出化学方程式;
解答 解:(1)二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的电子式为: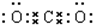 ,
,
故答案为: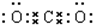 ;
;
(2)将硫化钠溶液与氯化铝溶液混合,有白色沉淀和气体生成是发生了双水解反应生成氢氧化铝沉淀和硫化氢气体,反应的离子方程式为:2Al3++3S2-+6H2O═2Al(OH)3↓+3H2S↑,
故答案为:2Al3++3S2-+6H2O═2Al(OH)3↓+3H2S↑;
(3)将NH3通过灼热的CuO,有无色无味的难溶于水的气体生成,是氨气的还原性被氧化铜氧化生成氮气和水,反应的化学方程式为:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O,
故答案为:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O;
(4)由电子守恒:n(Co3+)=2 n(Cl2)=2×$\frac{6.72L}{22.4L/mol}$=0.6 mol,由电荷守恒:n(Co原子)总=n(Co2+)溶液=$\frac{1}{2}$n(Cl-)=$\frac{1}{2}$×( 0.48L×5mol/L-2×0.3mol)=0.9 mol,所以固体中的n(Co2+)=0.9mol-0.6mol=0.3 mol,根据化合价电荷守恒为0,氧化物中n(O)=(0.3mol×2+0.6mol×3)÷2=1.2mol,故该钴氧化物中n(Co):n(O)=0.9mol:1.2mol=3:4,故氧化物的化学式为:Co3O4,和盐酸反应的化学方程式为:Co3O4+8HCl═3CoCl2+Cl2+4H2O,
故答案为:Co3O4+8HCl═3CoCl2+Cl2+4H2O;
点评 本题考查了电子式、物质性质和化学式计算应用等,题目难度中等,注意掌握电子式的正确表示方法,明确物质性质是解题关键.

 科学实验活动册系列答案
科学实验活动册系列答案①加大盐酸用量 ②增大盐酸浓度 ③粉碎石灰石 ④增大体系压强.
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ③④ |
 室温下,在0.2mol•L-1 Al2(SO4)3溶液中,逐滴加入1.0mol•L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法错误的是( )
室温下,在0.2mol•L-1 Al2(SO4)3溶液中,逐滴加入1.0mol•L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法错误的是( )| A. | a点时,溶液呈酸性的原因是:Al3++3H2O?Al(OH)3↓+3H+ | |
| B. | b~c段,加入的NaOH主要用于生成Al(OH)3沉淀 | |
| C. | c′~d段,溶液显碱性的原因是:NaOH═Na++OH- | |
| D. | d~e段,发生的反应为:Al(OH)3+NaOH═NaAlO2+2H2O |

| A. | Z一定是活泼的金属 | |
| B. | Y的最高价氧化物的水化物是一种强酸 | |
| C. | Z的最高价氧化物的水化物是强酸 | |
| D. | 1molY单质跟足量水反应时,有3 mol电子发生转移 |
| A. | 表面富有光泽 | B. | 有可成键的电子 | ||
| C. | 有金属离子 | D. | 有自由运动的电子 |
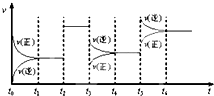 某密闭容器中发生如下反应:2X(g)+Y(g)?Z(g);△H<0 下图是表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5 时刻外界条件有所改变,但都没有改变各物质的用量.则下列说法中不正确的是( )
某密闭容器中发生如下反应:2X(g)+Y(g)?Z(g);△H<0 下图是表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5 时刻外界条件有所改变,但都没有改变各物质的用量.则下列说法中不正确的是( )| A. | t3 时减小了压强 | |
| B. | t5 时增大了压强 | |
| C. | t6 时刻后反应物的转化率最低 | |
| D. | t1-t2 时该反应的平衡常数大于 t6时反应的平衡常数 |