题目内容
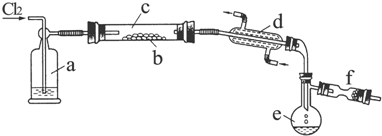
4.实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4•H2O),过程如下: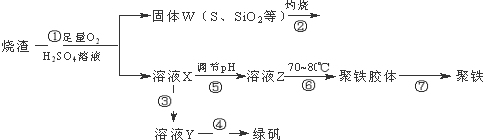
请回答下列问题:
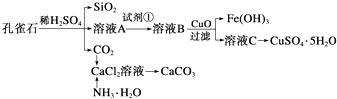
(1)写出过程①中FeS和O2、H2SO4反应的化学方程式:4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S.
(2)将过程②中产生的气体通入下列溶液中,溶液会腿色的是ACD.
A.品红溶液 B.紫色石蕊试液 C.酸性高锰酸钾溶液 D.溴水
(3)过程③中,需要加入的物质是Fe(化学式).
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有蒸发皿、玻璃棒.
(5)过程⑥中,将溶液Z加热到70~80℃,目的是升高温度,促进铁离子水解.
分析 硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4•7H2O),烧渣在硫酸溶液中通入足量氧气,反应后过滤得到固体W和溶液X,溶液X加入铁反应生成硫酸亚铁,蒸发浓缩结晶析出得到绿矾,溶液X中加入试剂调节溶液PH得到溶液Z加热制备聚铁胶体得到聚铁;
(1)根据反应物和生成物的种类结合质量守恒书写化学方程式;
(2)过程②产生的气体为SO2,具有还原性和漂白性;
(3)溶液X中含有Fe3+,要制备绿矾,应加入Fe使之还原为Fe2+;
(4)蒸发结晶需要使用酒精灯、三角架、蒸发皿、玻璃棒等仪器;
(5)过程⑤⑥目的为促进的水解,加热有利于水解的进行.
解答 解:(1)反应物为FeS、O2和H2SO4,生成物有S,根据质量守恒还应有Fe2(SO4)3和H2O,
反应的化学方程式为4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S,
故答案为:4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S;
(2)过程②产生的气体为SO2,具有还原性和漂白性,因具有漂白性而使品红褪色,因具有还原性而使具有氧化性的酸性KMnO4溶液、溴水褪色,故答案为:ACD;
(3)溶液X中含有Fe3+,要制备绿矾,应加入Fe使之还原为Fe2+,加入铁可生成Fe2+,并且不引入新的杂质,
故答案为:Fe;
(4)蒸发结晶需要使用酒精灯、三角架、蒸发皿、玻璃棒等仪器,可能还需要泥三角,故答案为:蒸发皿、玻璃棒;
(5)过程⑤⑥目的为促进的水解,加热有利于水解的进行,促进Fe3+的水解,
故答案为:升高温度,促进铁离子水解.
点评 本题考查较为综合,涉及物质含量的测定、制备实验方案的设计等知识,题目难度中等,注意常见化学实验操作方法.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案| 化学键 | N≡N | H-H | N-H |
| 键能/kJ•mol-1 | a | b | c |
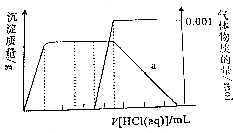 某溶液中只可能含有CO32-、AlO2-、Fe3+、Na+、SiO32-、NH3•H2O中的几种粒子,在振荡情况下,不断滴入稀盐酸,根据实验现象作出如下图象:则对该溶液的下列判断正确的是( )
某溶液中只可能含有CO32-、AlO2-、Fe3+、Na+、SiO32-、NH3•H2O中的几种粒子,在振荡情况下,不断滴入稀盐酸,根据实验现象作出如下图象:则对该溶液的下列判断正确的是( )| A. | 溶液呈碱性,一定不含Fe3+、和NH3•H2O,c(CO3 2-) 为0.001mol/L | |
| B. | 与H+反应的先后次序是:AlO2-、NH3•H2O、CO32-、HCO3-、A l(OH)3 | |
| C. | 一定含有CO32-、AlO2-、Na+、NH3•H2O,可能 含有SiO32- | |
| D. | a点溶液中存在:c(Na+)+c(H+)+3c(Al3+)=c(OH-)+c(Cl-) |
| A. | 表面富有光泽 | B. | 有可成键的电子 | ||
| C. | 有金属离子 | D. | 有自由运动的电子 |
 .
.