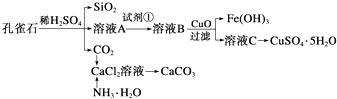
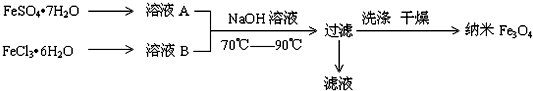
题目内容
8.将 4mol A 气体和 2mol B 气体在 2L 的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)?2C(g),若经 2s(秒)后测得C的浓度为0.6mol•L-1,现有下列几种说法,其中正确的是( )
| A. | 用物质 A 表示的反应的平均速率为 0.3 mol•L-1•s-1 | |
| B. | 用物质 B 表示的反应的平均速率为 0.6 mol•L-1•s-1 | |
| C. | 2 s 时物质 A的转化率为70% | |
| D. | 2 s 时物质 B的浓度为 0.7 mol•L-1 |
分析 将 4mol A 气体和 2mol B 气体在 2L 的容器中,若经2s后测得C的浓度为0.6mol•L-1,则C的物质的量为2L×0.6mol/L=1.2mol,则:
2A(g)+B(g)?2C(g)
开始(mol):4 2 0
转化(mol):1.2 0.6 1.2
2s时(mol):2.8 1.4 1.2
A.根据v=$\frac{△c}{△t}$计算v(A);
B.根据v=$\frac{△c}{△t}$计算v(B);
C.A的转化率=$\frac{消耗A的物质的量}{A的起始物质的量}$×100%;
D.根据c=$\frac{n}{V}$计算B的浓度.
解答 解:将 4mol A 气体和 2mol B 气体在 2L 的容器中,若经2s后测得C的浓度为0.6mol•L-1,则C的物质的量为2L×0.6mol/L=1.2mol,则:
2A(g)+B(g)?2C(g)
开始(mol):4 2 0
转化(mol):1.2 0.6 1.2
2s时(mol):2.8 1.4 1.2
A.v(A)=$\frac{\frac{1.2mol}{2L}}{2s}$=0.3 mol•L-1•s-1,故A正确;
B.v(B)=$\frac{\frac{0.6mol}{2L}}{2s}$=0.15 mol•L-1•s-1,故B错误;
C.2sA的转化率=$\frac{1.2mol}{4mol}$×100%=30%,故C错误;
D.2s时B的浓度为$\frac{1.4mol}{2L}$=0.7mol/L,故D正确,
故选:AD.
点评 本题考查化学平衡计算、反应速率计算,比较基础,注意三段式解题法在化学平衡计算中应用.

| A. | 硬币 | B. | 聚氯乙烯塑料 | C. | 氮化硅陶瓷 | D. | 钢筋混凝土 |
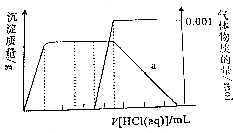 某溶液中只可能含有CO32-、AlO2-、Fe3+、Na+、SiO32-、NH3•H2O中的几种粒子,在振荡情况下,不断滴入稀盐酸,根据实验现象作出如下图象:则对该溶液的下列判断正确的是( )
某溶液中只可能含有CO32-、AlO2-、Fe3+、Na+、SiO32-、NH3•H2O中的几种粒子,在振荡情况下,不断滴入稀盐酸,根据实验现象作出如下图象:则对该溶液的下列判断正确的是( )| A. | 溶液呈碱性,一定不含Fe3+、和NH3•H2O,c(CO3 2-) 为0.001mol/L | |
| B. | 与H+反应的先后次序是:AlO2-、NH3•H2O、CO32-、HCO3-、A l(OH)3 | |
| C. | 一定含有CO32-、AlO2-、Na+、NH3•H2O,可能 含有SiO32- | |
| D. | a点溶液中存在:c(Na+)+c(H+)+3c(Al3+)=c(OH-)+c(Cl-) |
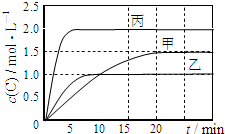 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以如表和如图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以如表和如图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
| A. | x=1 | |
| B. | 10min内乙容器中反应的平均速率v(B)=0.025mol•L-1•min-1 | |
| C. | 由图可知:T1<T2,且该反应为吸热反应 | |
| D. | T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为75% |
 室温下,在0.2mol•L-1 Al2(SO4)3溶液中,逐滴加入1.0mol•L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法错误的是( )
室温下,在0.2mol•L-1 Al2(SO4)3溶液中,逐滴加入1.0mol•L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法错误的是( )| A. | a点时,溶液呈酸性的原因是:Al3++3H2O?Al(OH)3↓+3H+ | |
| B. | b~c段,加入的NaOH主要用于生成Al(OH)3沉淀 | |
| C. | c′~d段,溶液显碱性的原因是:NaOH═Na++OH- | |
| D. | d~e段,发生的反应为:Al(OH)3+NaOH═NaAlO2+2H2O |
| A. | 不可能是BaSO4 | B. | 一定是BaSO3 | ||
| C. | 一定是BaSO4 | D. | 一定是BaSO3和BaSO4 |