题目内容
3.室温下,设1LpH=6的AlCl3溶液中,由水电离出的H+物质的量为n1;1LpH=6的HCl溶液中,由水电离出的H+物质的量为n2.则$\frac{{n}_{1}}{{n}_{2}}$的值是( )| A. | 1 | B. | 100 | C. | 1000 | D. | 10000 |
分析 酸或碱抑制水电离,含有弱离子的盐促进水电离,所以盐酸抑制水电离,氯化铝促进水电离,pH=6的1L盐酸中,水电离出n(H+)=$\frac{1{0}^{-14}}{1{0}^{-6}}$mol/L×1L=10-8 mol,1L pH=6的氯化铝溶液中水电离出n(H+)=10-6 mol/L×1L=10-6mol,据此计算.
解答 解:酸或碱抑制水电离,含有弱离子的盐促进水电离,所以盐酸抑制水电离,氯化铝促进水电离,pH=6的1L盐酸中,水电离出n(H+)=$\frac{1{0}^{-14}}{1{0}^{-6}}$mol/L×1L=10-8 mol,氯化铝溶液中水电离出氢离子浓度等于溶液中氢离子浓度,所以1L pH=6的氯化铝溶液中水电离出n(H+)=10-6 mol/L×1L=10-6mol,则$\frac{{n}_{1}}{{n}_{2}}$=$\frac{1{0}^{-6}mol}{1{0}^{-8}mol}$=100,
故选B.
点评 本题以pH的简单计算为载体考查水的电离,明确水电离影响因素是解本题关键,易错点是计算溶液中水电离出氢离子浓度,注意:酸中水电离出氢离子浓度不等于溶液中氢离子浓度,题目难度不大.

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
14.金属是热和电的良好导体,因为它( )
| A. | 表面富有光泽 | B. | 有可成键的电子 | ||
| C. | 有金属离子 | D. | 有自由运动的电子 |
18.在有催化剂存在的条件下,将2体积的SO2和1体积的O2混合装入密闭容器中并加热一段时间后,将混合气体通入BaCl2溶液中,产生的沉淀( )
| A. | 不可能是BaSO4 | B. | 一定是BaSO3 | ||
| C. | 一定是BaSO4 | D. | 一定是BaSO3和BaSO4 |
8.在相同温度相同体积的甲、乙两容器中发生反应2SO2(g)+O2(g)═2SO3(g),甲容器中充入1molSO2和1molO2,乙容器充入2molSO2和2molO2.下列叙述错误的是( )
| A. | 化学反应速率:乙>甲 | B. | 平衡后O2的浓度:乙>甲 | ||
| C. | 平衡后SO2的转化率:乙>甲 | D. | 平衡后混合气体的密度:乙>2甲 |
15.你认为下列数据可信的是( )
| A. | 某溶液中溶质的质量分数超过100% | B. | 某常见气体的密度为1.8g/cm3 | ||
| C. | 用10ml量筒量取5.23ml浓硫酸 | D. | 用托盘天平称得氯化钠 5.0g |
12.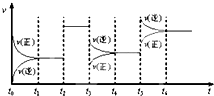 某密闭容器中发生如下反应:2X(g)+Y(g)?Z(g);△H<0 下图是表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5 时刻外界条件有所改变,但都没有改变各物质的用量.则下列说法中不正确的是( )
某密闭容器中发生如下反应:2X(g)+Y(g)?Z(g);△H<0 下图是表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5 时刻外界条件有所改变,但都没有改变各物质的用量.则下列说法中不正确的是( )
 某密闭容器中发生如下反应:2X(g)+Y(g)?Z(g);△H<0 下图是表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5 时刻外界条件有所改变,但都没有改变各物质的用量.则下列说法中不正确的是( )
某密闭容器中发生如下反应:2X(g)+Y(g)?Z(g);△H<0 下图是表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5 时刻外界条件有所改变,但都没有改变各物质的用量.则下列说法中不正确的是( )| A. | t3 时减小了压强 | |
| B. | t5 时增大了压强 | |
| C. | t6 时刻后反应物的转化率最低 | |
| D. | t1-t2 时该反应的平衡常数大于 t6时反应的平衡常数 |