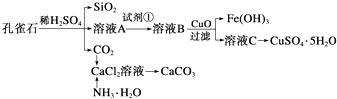
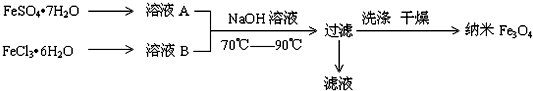
题目内容
1.活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),反应方程式为NO+C?E+F(未配平).当温度为T时,经过5min达到平衡,测得平衡时各物质的物质的量如下表:| 活性炭 | NO | E | F | |
| 初始时(mol) | 2.050 | 0.200 | 0 | 0 |
| 平衡时(mol) | 2.000 | 0.100 | 0.050 | 0.050 |
| A. | 该反应的平衡常数为$\frac{1}{4}$ | |
| B. | 增加活性炭的量,能缩短达到平衡所用的时间 | |
| C. | 容器中压强不变可以说明该反应达到平衡状态 | |
| D. | 达到平衡时,用E表示该反应的速率为0.01 mol•L-1•min-1 |
分析 NO和活性炭(无杂质)反应生成E和F,由表中数据可知,平衡时C(s)、NO、E、F的物质的量变化分别为0.05mol、0.1mol、0.05mol、0.05mol,物质的量之比为1:2:1:1,结合原子守恒可知,反应方程式为:C(s)+2NO(g)?N2(g)+CO2(g).
A.根据K=$\frac{c({N}_{2})×c(C{O}_{2})}{{c}^{2}(NO)}$计算;
B.活性炭为固体,增加活性炭的量,不影响反应速率;
C.反应前后气体的物质的量不变,恒温恒容下,容器内压强始终不变;
D.根据v=$\frac{△c}{△t}$计算用E表示该反应的速率.
解答 解:NO和活性炭(无杂质)反应生成E和F,由表中数据可知,平衡时C(s)、NO、E、F的物质的量变化分别为0.05mol、0.1mol、0.05mol、0.05mol,物质的量之比为1:2:1:1,结合原子守恒可知,反应方程式为:C(s)+2NO(g)?N2(g)+CO2(g).
A.平衡常数K=$\frac{c({N}_{2})×c(C{O}_{2})}{{c}^{2}(NO)}$=$\frac{\frac{0.05}{2}×\frac{0.05}{2}}{(\frac{0.1}{2})^{2}}$=$\frac{1}{4}$,故A正确;
B.活性炭为固体,增加活性炭的量,不影响反应速率,不能缩短达到平衡所用的时间,故B错误;
C.反应前后气体的物质的量不变,恒温恒容下,容器内压强始终不变,故C错误;
D.E表示该反应的速率为$\frac{\frac{0.05mol}{2L}}{5min}$=0.005 mol•L-1•min-1,故D错误,
故选:A.
点评 本题考查化学平衡计算、平衡常数、平衡状态判断、反应速率计算等,关键是根据物质的量变化确定反应方程式,难度中等.

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
| A. | 实验①中,若5min 时测得 n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol/min | |
| B. | 实验②中,该反应的平衡常数K=2.0 | |
| C. | 实验③中,达到平衡时,X的转化率为60% | |
| D. | 实验④中,达到平衡时,b>0.060 |
①加大盐酸用量 ②增大盐酸浓度 ③粉碎石灰石 ④增大体系压强.
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ③④ |
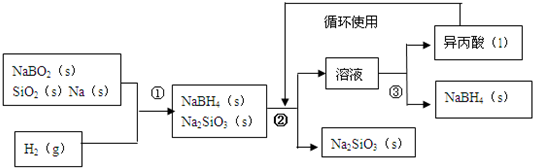
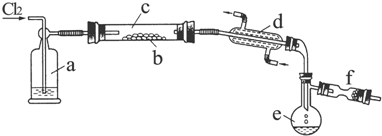
 .
.