题目内容
【题目】一种磁性材料的磨削废料(含镍质量分数约21%)主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物。用该废料制备纯度较高的氢氧化镍,工艺流程如图所示:
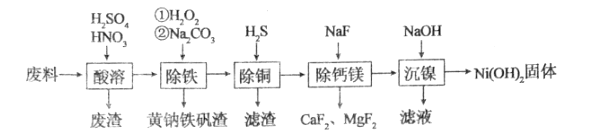
请回答下列问题:
(1)为了提高“酸溶”工序中原料的浸出效率,采取的措施不合理的有______。
A.搅拌
B.适当升高温度
C.研磨矿石
D.用浓硫酸
(2)“酸溶”时,溶液中有Fe3+、Fe2+、Ni2+等生成,废渣的主要成分是______;合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,反应有N2生成,金属镍溶解的离子方程式为______。
(3)“除铁”时控制温度不超过40℃的原因是______;加入碳酸钠的目的是______。
(4)Fe2+也可以用NaClO3氧化,生成的Fe3+在较小pH条件下水解,最终形成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀而被除去,图表示pH-温度关系,图中阴影部分为钠铁矾稳定存在的区域。

则下列说法不正确的是______(填字母)
a.黄钠铁矾[Na2Fe6(SO4)4(OH)12]中铁为+2价
b.pH过低或过高均不利于生成黄钠铁矾,其原因相同
c.氯酸钠在氧化Fe2+时,1 molNaClO3得到的电子数为6NA
d.工业生产中温度常保持在85℃-95℃,控制溶液的pH为1.2~1.8,此时加入Na2SO4后生成黄钠铁矾
(5)“除铜”时,反应的离子方程式为______,若用Na2S代替H2S除铜,优点是______。
(6)已知某温度下Ksp[Ni(OH)2]=4.0×10-15,该流程在“沉镍”过程中需调节溶液pH约为______,Ni2+才刚好沉淀完全(离子沉淀完全的浓度≤10-5mol/L;lg2=0.30)。
【答案】D SiO2 5Ni+12H++2NO3-=5Ni2++N2↑+6H2O 温度过高过氧化氢分解,浓度降低 调节溶液pH,使Fe3+完全沉淀为黄钠铁矾 ab Cu2++H2S=CuS↓+2H+ 不会有易挥发的有毒气体H2S逸出,保护环境 9.3
【解析】
废料与稀硫酸、稀硝酸溶液反应生成硫酸亚铁、硫酸镍,双氧水具有强氧化性,加入双氧水的目的是将Fe2+氧化成Fe3+,加入碳酸钠调节pH,除去Fe3+,通入硫化氢除去Cu2+,硫化氢可与Cu2+反应生成CuS,加入氟化钠,可生成氟化钙、氟化镁沉淀,最后调节pH生成氢氧化镍沉淀,据此分析;
(1)“酸溶”中增大原料的利用率,可以采取的措施是搅拌、适当升高温度、粉碎(或研磨)、适当增加酸的浓度,但是不能用浓硫酸,因为铁与浓硫酸发生钝化反应,不符合该工艺流程,故D符合题意;
(2)废料是铁镍合金,含有CuO、CaO、MgO、SiO2,铁镍合金能与混酸反应转化成相应的离子,CuO、CaO、MgO为碱性氧化物,能与酸反应生成相应的离子,SiO2属于酸性氧化物,不溶于水,且不与硫酸和硝酸反应,因此废渣的主要成分是SiO2;镍与硝酸反应生成Ni2+和N2,其离子方程式为5Ni+12H++2NO3-=5Ni2++N2↑+6H2O;
(3)除铁时需要加入H2O2,H2O2不稳定受热易分解,因此控制温度不超过40℃的原因是防止温度过高过氧化氢分解,浓度降低;加入碳酸钠的目的是调节pH,使Fe3+完全沉淀为黄钠铁矾;
(4)a.根据化合价代数和为0,推出Fe的化合价为+3价,故a说法错误;
b.根据图像,pH过低会将黄钠铁矾溶解,pH过高则不会生成黄钠铁矾,其原因不同,故b说法错误;
c.1molNaClO3氧化Fe2+,得到电子物质的量为1mol×1×[5-(-1)]=6mol,故c说法正确;
d.工业生产中温度常保持在85℃~95℃,加入Na2SO4后生成黄钠铁矾,结合图可知此时溶液的pH约为1.2~1.8,故d说法正确;
故答案选ab;
(5)根据流程,加入H2S除Cu2+,CuS不溶于硫酸,即发生离子方程式为Cu2++H2S=CuS↓+2H+;H2S具有臭鸡蛋气味的气体,有毒,污染环境,Na2S代替H2S,优点是不会有易挥发的有毒气体H2S逸出,保护环境;
(6)Ni2+才刚好沉淀完全时,c(Ni2+)小于等于10-5mol·L-1,根据溶度积得出,c(OH-)= =2.0×10-5mol·L-1,pOH=5-lg2=5-0.3=4.7,即pH=14-4.7=9.3。
=2.0×10-5mol·L-1,pOH=5-lg2=5-0.3=4.7,即pH=14-4.7=9.3。

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案