题目内容
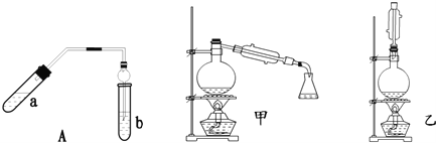
【题目】亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水、和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图所示。
已知:室温下,①2NO+Na2O2=2NaNO2
②酸性条件下,NO或NO2—都能与MnO4—反应生成NO3—和Mn2+,5 NO2— + 2MnO4—+ 6H+= 5NO3—+ 2Mn2++ 3H2O
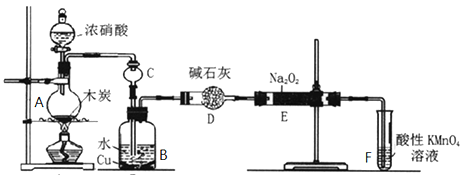
(1)A中观察到的现象__________________________。
(2)装置B中反应的离子方程式有____________________,_____________________。
(3)装置C的作用:____________________,装置F的作用:___________________。
(4)若无装置D,则E中产物除亚硝酸钠外还含有副产物__________________。(填化学式)
(5)NaNO2有像食盐一样的咸味,但能引起中毒。已知亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O,根据上述反应,可以用试剂和生活中常见的物质进行实验,以鉴别亚硝酸钠和食盐。进行实验时,必须选用的物质有__________________。
A.自来水 B.碘化钾淀粉试液 C.淀粉 D.白糖 E.食醋 F.白酒
(6)充分反应后,某同学设计实验对E中NaNO2的含量进行检测。称取E中固体2g,完全溶解配制成溶液100 mL,取出25 mL溶液用0.100 mol/L酸性KMnO4溶液进行滴定(杂质不与KMnO4反应),消耗KMnO4溶液20mL,求样品中亚硝酸钠的质量分数(只列式,不用化简,不用计算,已知:NaNO2摩尔质量69g/mol)____________________________。
【答案】有红棕色气体生成 3NO2+H2O=2H++2NO3-+NO↑ 3Cu+8H++2NO3— = 3Cu2++2NO↑+4H2O 防止倒吸 吸收未反应的NO Na2CO3、NaOH BE 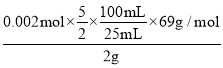 ×100%
×100%
【解析】
装置A中发生浓硝酸和碳加热的反应,反应生成二氧化氮和二氧化碳和水,装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,硝酸和铜反应生成硝酸铜,一氧化氮和水,装置D干燥NO气体,并吸收二氧化碳;根据题示信息,装置E中的过氧化钠吸收一氧化氮,最后通过酸性高锰酸钾溶液除去尾气中剩余的一氧化氮,防止污染空气,据此分析解答。
(1)根据装置图可知,A中浓硝酸与木炭发生氧化还原反应生成CO2和NO2以及水,因此A中观察到的现象是:有红棕色气体生成,故答案为:有红棕色气体生成;
(2)NO2溶于水生成NO和硝酸,3NO2+H2O=2HNO3+NO↑,硝酸具有氧化性能把金属铜氧化,则装置B中反应的离子方程式有3NO2+H2O=2H++2NO3-+NO↑、3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:3NO2+H2O=2H++2NO3-+NO↑;3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(3)NO2极易溶于水,且能与水反应,所以装置C的作用是防止倒吸;NO与过氧化钠反应属于气体与固体的反应,反应不充分,反应后NO有剩余,随意排放容易引起大气污染,而NO能被酸性高锰酸钾溶液氧化,则装置F的作用吸收未反应的NO,故答案为:防止倒吸;吸收未反应的NO;
(4)生成的NO中含有CO2和水蒸气,CO2和水蒸气均能与过氧化钠反应,2Na2O2 + 2H2O = 4NaOH + O2 ↑、2Na2O2 +2CO2 == 2Na2CO3 + O2,而碱石灰可以吸收CO2和水蒸气,所以如果没有D装置,则E中产物除亚硝酸钠外还含有副产物Na2CO3、NaOH,故答案为:Na2CO3、NaOH;
(5)鉴别NaNO2和NaCl,由2NaNO2+4HI═2NO+I2+2NaI+2H2O及碘遇淀粉变蓝可知,进行实验时,必须选用的物质有碘化钾淀粉试液、食醋,故答案为:BE;
(6)消耗高锰酸钾的物质的量是0.1mol/L×0.02L=0.002mol,则根据方程式5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O可知,亚硝酸钠的物质的量是0.002mol×![]() ,则原样品中亚硝酸钠的物质的量是0.002mol×
,则原样品中亚硝酸钠的物质的量是0.002mol×![]() ×
×![]() ,其质量为0.002mol×
,其质量为0.002mol×![]() ×
×![]() ×69g/mol,所以样品中亚硝酸钠的质量分数
×69g/mol,所以样品中亚硝酸钠的质量分数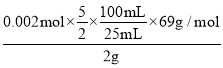 ×100%,故答案为:
×100%,故答案为: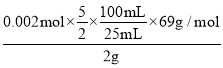 ×100%。
×100%。

 阅读快车系列答案
阅读快车系列答案【题目】(1)常温下,向20mL0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。回答下列问题
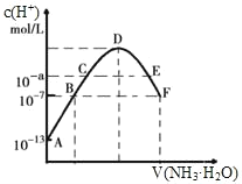
①NaHB溶液呈_______(填“酸性”“碱性”或“中性”)
②A、D、E三点溶液的pH由大到小为:_______
③F点溶液c(NH4+)_______2c(B2-)(填“>”“<”或“=”)
(2)某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
(查阅资料)25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
(实验探究)向2支均盛有1mL0.1mol/LMgCl2溶液的试管中分别加入2滴2mol/LNaOH溶液,制得等量Mg(OH)2沉淀。
①分别向两支试管中加入不同试剂,请填写下表中的实验现象(用下列选项中字母代号填写)
试管编号 | 加入试剂 | 实验现象 |
Ⅰ | 2滴0.1mol/LFeCl3溶液 | _______ |
Ⅱ | 4mL2mol/LNH4Cl溶液 | _______ |
A 白色沉淀转化为红褐色沉淀 B 白色沉淀不发生改变
C 红褐色沉淀转化为白色沉淀 D 白色沉淀溶解,得无色溶液
②同学们猜想实验Ⅱ中沉淀溶解的主要原因有两种:
猜想1:NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的沉淀溶解平衡正向移动。猜想2:_______。
(3)为验证猜想,同学们取少量相同质量的氢氧化镁固体盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解。该实验证明正确的是_______(填“猜想1”或“猜想2”)。