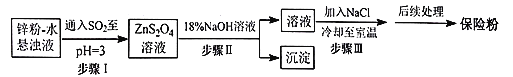
题目内容
【题目】氯气是一种清洁、高效新能源, 也是重要的化工原料。
(1)通过热化学循环在较低温度下由硫化氢分解制备氢气的反应系统原理为:
SO2(g)+I2(s)+2H2O(l)=2HI(aq)+H2SO4(aq) H1=-151kJmol-1
2HI(aq)=H2(g)+I2(s) H2=+110kJmol-1
H2S(g)+H2SO4(aq)=S(s)+SO2(g)+2H2O(l) H3=+61kJmol-1
(热化学硫碘循环硫化氢分解联产氢气、硫磺系统)
通过计算可知,该系统制氢的热化学方程式为___________。
(2)工业上利用CO和H2合成清洁能源CH3OH,其反应为CO(g)+2H2(g)CH3OH(g)ΔH= -116 kJ·mol-1。如图表示CO的平衡转化率(α)随温度和压强变化的示意图:
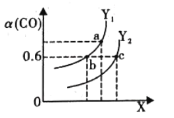
①X 表示的是______ (填“温度”或“压强”) ,理由是_________;Y1______Y2 (填“<”、“ >”或“=”)
②在2L恒容密闭容器中充入2 mol CO 和4 mol H2,一定条件下经过10 min 达到平衡状态c 点处。在该条件下,从开始至达到平衡状态v(CH3OH) =______ molL-1min -1,平衡常数K=________(填最简分数)。平衡常数Ka、Kb、Kc的大小关系是______
③下列措施既能增大反应速率又能提高反应物转化率的是______ (填字母)。
A. 使用催化剂 B. 及时分离CH3OH C.升高温度 D.增大压强
(3) 已知燃料电池的比能最与单位质量燃料物质失去的电子数成正比。理论上H2、CH4、CH3OH的碱性电池的比能量由大到小的顺序为_________。
【答案】H2S(g) = S(s) + H2(g) H = + 20 kJmol-1 压强 升温,平衡向吸热反应移动即逆向移动,转化率减小,因此X为压强,增大压强,平衡正向移动,转化率增大 < 0.06 ![]() Ka = Kc < Kb D H2 > CH4 > CH3OH
Ka = Kc < Kb D H2 > CH4 > CH3OH
【解析】
(1)根据盖斯定律,三个方程式相加得到。
(2)①CO的平衡转化率(α)增大,说明平衡正向移动,则只能是加压,从下往上,转化率升高,平衡正向移动,则为降温;②三段式建立关系,得出甲醇反应速率,再计算平衡常数,再得出平衡常数大小比较;③A. 使用催化剂,反应速率加快,但转化率不变;B. 及时分离CH3OH,浓度减小;C. 升高温度,反应速率加快,平衡逆向移动,转化率减小,;D. 增大压强,速率加快,平衡正向移动,转化率增大。
(3)单位质量燃料物质失去的电子数越多,则燃料电池的比能量最大,计算三者的比能量得出结论。
(1)根据盖斯定律,三个方程式相加得到H2S(g) = S(s) + H2(g) H = + 21 kJmol-1;故答案为:H2S(g) = S(s) + H2(g) H = + 20 kJmol-1。
(2)①CO的平衡转化率(α)增大,说明平衡正向移动,则只能是加压,因此X表示的是压强,理由是升温,平衡向吸热反应移动即逆向移动,转化率减小,因此X为压强;从下往上,转化率升高,平衡正向移动,则为降温,因此Y1<Y2 ;故答案为:压强;升温,平衡向吸热反应移动即逆向移动,转化率减小,因此X为压强;<。
②

从开始至达到平衡状态![]() ,平衡常数
,平衡常数 ,b、c温度相同,平衡常数相同,a点温度低,平衡正向移动,平衡常数增大,因此平衡常数Ka = Kc < Kb;故答案为:0.06;
,b、c温度相同,平衡常数相同,a点温度低,平衡正向移动,平衡常数增大,因此平衡常数Ka = Kc < Kb;故答案为:0.06;![]() ;Ka = Kc < Kb。
;Ka = Kc < Kb。
③A. 使用催化剂,反应速率加快,但转化率不变,故A不符合题意;B. 及时分离CH3OH ,浓度减小,反应速率减慢,故B不符合题意;C. 升高温度,反应速率加快,平衡逆向移动,转化率减小,故C不符合题意;D. 增大压强,速率加快,平衡正向移动,转化率增大,故D符合题意;综上所述,答案为D。
(3)单位质量燃料物质失去的电子数越多,则燃料电池的比能量最大,H2比能量为![]() ,CH4比能量为
,CH4比能量为![]() ,CH3OH比能量为
,CH3OH比能量为![]() ,因此三者比能量由大到小的顺序为H2 > CH4 > CH3OH;故答案为:H2 > CH4 > CH3OH。
,因此三者比能量由大到小的顺序为H2 > CH4 > CH3OH;故答案为:H2 > CH4 > CH3OH。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案【题目】用中和滴定法测定某烧碱的纯度。将2.5g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成250mL溶液。根据实验回答下列问题:
I.滴定前的准备
检漏→用蒸馏水清洗→用待装溶液润洗→装液→①→调节液而在“0”刻度或“0”刻度以下→记录初始读数
II.滴定
分别取20.00mL待测液于3个洁净的锥形瓶中,滴加2滴酚酞试液,然后用0.2000mol·L-1盐酸标准液进行滴定至终点,记录最终读数。数据如下:
滴定序号 | 待测液体积(mL) | 滴定前(mL) | 滴定后(mL) |
1 | 20.00 | 0.50 | 20.70 |
2 | 20.00 | 6.00 | 26.00 |
3 | 20.00 | 5.00 | 25.10 |
III.实验数据处理
(1)将步骤I中的操作补充完整:
①___________
(2)如图所示为___________ (填“酸式”或“碱式”)滴定管的一部分,若该滴定管漏水或转动不灵活,可采取的措施是___________
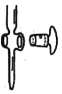
(3)滴定终点的现象是_______
(4)计算:NaOH溶液的浓度为_______mol·L-1烧碱样品的纯度为________
(5)试判断以下几种情况对烧碱纯度测定结果的影响(填“偏大”、“偏小”或“无影响”)
①若用蒸馏水冲洗锥形瓶,使测定结果_____________
②若滴定前滴定管尖嘴有气泡,滴定后气泡消失,使测定结果_____________
③若刚见到指示剂局部的颜色有变化就停止滴定,使测定结果_____________
④读数时,若滴定前仰视,滴定后俯视,使测定结果_____________