题目内容
【题目】铁氰化钾(化学式为K3[Fe(CN)6])在工业上主要应用于制药、电镀、造纸、钢铁生产,其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。回答下列问题:
(1)Fe3+比Fe2+稳定的原因______。
(2)在[Fe(CN)6]3-中不存在的化学键为______。
A.离子键
B.配位键
C.氢键
D.共价键
(3)已知(CN)2性质与卤素相似,化学上称为类卤化合物。
(CN)2+2 KOH═KCN+KCNO+H2O
KCN+HCl═HCN+KCl
C2H2+HCN→CH2=CH-C≡N
①KCNO中各元素原子的第一电离能由大到小排序为______。
②丙烯腈(CH2=CH-C≡N)分子中碳原子轨道杂化类型是______,分子中σ键和π键数目之比为______。
(4)氮化铁晶体的晶胞结构如图1所示,该晶体中铁、氮的微粒个数之比为______。
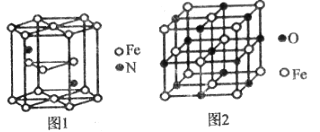
(5)已知:氧化亚铁晶体的密度为pgcm-3,NA表示阿伏加德罗常数的值。氧化亚铁晶体的晶胞如图2所示,该晶胞中,与O2-紧邻且等距离的O2-数目为______;Fe2+与O2-的最短核间距为______pm。
【答案】Fe3+的价电子排布式为3d5,半充满状态,能量低 A N>O>C>K sp、sp2 2:1 3:1 12 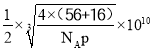 pm或
pm或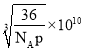 pm
pm
【解析】
(1)Fe3+的价电子排布式为3d5,Fe2+的价电子排布式为3d6,根据洪特规则进行分析;
(2)根据化学键的类型和特点解答,注意氢键是分子间作用力,不是化学键;
(3)①K为金属元素,容易失去电子,第一电离能最小,C、N、O中N的2p能级上有3个电子,处于半满状态,能量最低;
②利用价层电子对数等于杂化轨道数进行分析;成键原子间只能形成一个σ键,剩余为π键;(4)按照均摊法进行分析;
(5)根据晶胞结构,与O2-紧邻且等距的O2-同层4个,上层4个,下层4个;利用均摊法计算出微粒个数,从而计算出晶胞的质量,Fe2+和O2-最短的核间距是边长的一半,因此根据密度求出晶胞的体积,从而计算出边长;
(1) Fe3+的价电子排布式为3d5,处于半满,能量低,Fe2+的价电子排布式为3d6,因此Fe3+比Fe2+稳定;
(2)[Fe(CN)6]3-是阴离子,是配合物的内界,含有共价键和配位键,不含有离子键和氢键,但氢键属于分子间作用力,不属于化学键,故A符合题意;
(3)①K是活泼金属,容易失去电子,第一电离能最小,同周期从左向右第一电离能逐渐增大,但ⅡA>ⅢA,ⅤA>ⅥA,因此第一电离能大小顺序是N>O>C>K;
②“CH2=CH”中C有3个σ键,无孤电子对,因此C的杂化方式为sp2,叁键中C的杂化类型sp;单键为σ键,双键中有1个σ键和1个π键,叁键中有1个σ键和2个π键,分子中σ键和π键数目之比为6:3=2:1;
(4)Fe位于顶点、面心、内部,顶点被六个这样的晶胞共用,面心被2个晶胞共用,个数为![]() =6,N位于内部,个数为2,因此铁、氮的微粒个数之比为6:2=3:1;
=6,N位于内部,个数为2,因此铁、氮的微粒个数之比为6:2=3:1;
(5) 根据晶胞结构,与O2-紧邻且等距的O2-同层4个,上层4个,下层4个,共有12个;晶胞的质量为![]() g,根据密度的定义,该晶胞的边长为
g,根据密度的定义,该晶胞的边长为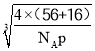 cm,Fe2+和O2-的最短核间距为边长的一半,因此最短距离是
cm,Fe2+和O2-的最短核间距为边长的一半,因此最短距离是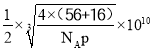 pm或
pm或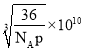 pm。
pm。