题目内容
2.已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质.下面给出14种元素的X的数值:| 元素 | H | Li | Be | B | C | O | F |
| X的数值 | 2.20 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 |
| 元素 | Na | Mg | Al | Si | P | S | Cl |
| X的数值 | 0.93 | 1.31 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)根据上表给出的数据,简述主族元素的X的数值大小与元素的金属性或非金属性强弱之间的关系元素X的数值越大,元素的非金属性越强;
(2)简述第二周期元素(除惰性气体外)的X的数值大小与原子半径之间的关系原子半径越小,X的数值越大.
(3)某化合物分子中含有S-N键,你认为该共用电子对偏向于N原子(填元素符号).
(4)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的化学键一般为离子键;当小于1.7时,一般为共价键.试推断AlBr3中的化学键类型是共价键.
(5)上表中元素形成的AB型化合物中,离子性最强的是NaF.
分析 (1)第三周期中随着原子序数的增大,X的数值依次增大;
(2)第二周期中随着原子序数的增大,半径碱性,据此解答;
(3)元素的非金属性越强,吸引电子能力越强,据此解答;
(4)根据X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键来分析;
(5)元素的金属性与非金属性越强,形成的离子化合物离子性越强.
解答 解:(1)由表格中的数据可知,金属性Na>Mg>Al,X的数值为Na<Mg<Al,则元素X的数值越大,元素的金属性越弱,故答案为:元素X的数值越大,元素的金属性越弱,即元素的非金属性越强;
(2)第二周期中随原子半径的减小,X的数值在增大,故原子半径越小,X的数值越大,故答案为:原子半径越小,X的数值越大;
(3)S的X数值为2.5,N的非金属性大于C(X的数值为2.5),则N的X数值大于S的X数值,即N的非金属性大于S的非金属性,即共用电子对偏向于N元素,故答案为:N;
(4)因表格中Al的X数值为1.61,Br的X数值为小于3.16,因Al、Br的X数值之差小于3.16-1.61=1.55<1.7,则形成共价键,故答案为:共价键;
(5)此表格中Na的金属性最强,F的非金属性最强,故NaF的离子性最强,故答案为:NaF.
点评 本题主要考查元素的性质及有机物结构测定方法,明确X的数值与非金属性的关键是解答本题的关键,较好的考查学生对表格中的数据分析整合、处理应用的能力,难度不大.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案
相关题目
12. 有A、B、C、D、E五种元素.其相关信息如下:
有A、B、C、D、E五种元素.其相关信息如下:
请回答下列问题.
(1)写出E元素原子基态时的电子排布式1s22s22p63s23p63d104s1;
(2)C元素的第一电离能比氧元素的第一电离能大 (填“大”或“小”);
(3)CA3分子中C原子的杂化轨道类型是sp3;
(4)A、C、E三种元素可形成[E(CA3)4]2+配离子,其中存在的化学键类型有①③ (填序号)
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为a (填序号);
a.平面正方形 b.正四面体 c.三角锥型 d.V型
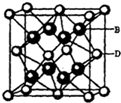
(5)B与D可形成离子化合物,其晶胞结构如图所示.其中D离子的配位数为8,若该晶体的密度为a g•cm-3,则该晶胞的体积是$\frac{\frac{78}{{N}_{A}}×4}{a}$cm3 (写出表达式即可).
 有A、B、C、D、E五种元素.其相关信息如下:
有A、B、C、D、E五种元素.其相关信息如下:| 元素 | 相关信息 |
| A | A原子的1s轨道上只有一个电子 |
| B | B是电负性最大的元素 |
| C | C的基态原子2p轨道有三个未成对电子 |
| D | D为主族元素,且与E同周期,其最外层上有两个运动状态不同的电子 |
| E | E能形成红色(或砖红色)的E2O和EO两种氧化物 |
(1)写出E元素原子基态时的电子排布式1s22s22p63s23p63d104s1;
(2)C元素的第一电离能比氧元素的第一电离能大 (填“大”或“小”);
(3)CA3分子中C原子的杂化轨道类型是sp3;
(4)A、C、E三种元素可形成[E(CA3)4]2+配离子,其中存在的化学键类型有①③ (填序号)
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为a (填序号);
a.平面正方形 b.正四面体 c.三角锥型 d.V型
(5)B与D可形成离子化合物,其晶胞结构如图所示.其中D离子的配位数为8,若该晶体的密度为a g•cm-3,则该晶胞的体积是$\frac{\frac{78}{{N}_{A}}×4}{a}$cm3 (写出表达式即可).
10.下列各组中属于同位素关系的是( )
| A. | 金刚石与石墨 | B. | T2O与H2O | C. | 40K与39K | D. | 16O与16O2- |
7.已知同一碳原子连有两个羟基不稳定: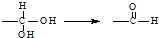 ,下列有关有机物
,下列有关有机物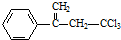 的说法不正确的是( )
的说法不正确的是( )
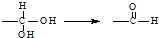 ,下列有关有机物
,下列有关有机物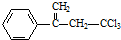 的说法不正确的是( )
的说法不正确的是( )| A. | 属于卤代烃,能使酸性高锰酸钾溶液和溴水褪色 | |
| B. | 该物质存在顺反异构 | |
| C. | 在碱性条件下充分水解,可生成羧酸盐 | |
| D. | 1mol 该物质在一定条件下可与4molH2发生加成反应 |
14.阿斯匹林的结构简式为: 则1mol阿斯匹林跟足量氢氧化钠溶液充分反应,消耗氢氧化钠的物质的量为( )
则1mol阿斯匹林跟足量氢氧化钠溶液充分反应,消耗氢氧化钠的物质的量为( )
 则1mol阿斯匹林跟足量氢氧化钠溶液充分反应,消耗氢氧化钠的物质的量为( )
则1mol阿斯匹林跟足量氢氧化钠溶液充分反应,消耗氢氧化钠的物质的量为( )| A. | 1mol | B. | 2mol | C. | 3mol | D. | 4mol |
11.下列各组数值表示有关元素的原子序数,其所表示的各原子中,能以离子键相互结合成AB2型稳定化合物的是( )
| A. | 18和12 | B. | 6和8 | C. | 11和16 | D. | 12和9 |
12.己烯雌酚是一种激素类药物,结构如图.下列有关叙述中不正确的是( )
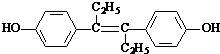

| A. | 它易溶于有机溶剂 | |
| B. | 可与NaOH和Na2CO3发生反应 | |
| C. | 1mol该有机物可以与5mol Br2发生反应 | |
| D. | 该有机物分子中,一定有14个碳原子共平面 |

 ;
;