题目内容
14.阿斯匹林的结构简式为: 则1mol阿斯匹林跟足量氢氧化钠溶液充分反应,消耗氢氧化钠的物质的量为( )
则1mol阿斯匹林跟足量氢氧化钠溶液充分反应,消耗氢氧化钠的物质的量为( )| A. | 1mol | B. | 2mol | C. | 3mol | D. | 4mol |
分析 阿司匹林含-COOH、-COOC-,结合羧酸、酯、苯酚的性质来解答.
解答 解:阿司匹林含-COOH、-COOC-,均能与NaOH溶液反应,且水解生成苯酚结构也与NaOH反应,
则1mol阿司匹林跟足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol,
故选C.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的官能团的性质,根据羧基、酯、苯酚的性质解答该题,难度不大.

练习册系列答案
相关题目
4.如图为短周期的一部分,Y原子最外层电子数是其电子层数的2倍,下列说法正确的是(
| R | ||
| X | Y | Z |
| A. | Y的氢化物比Z的氢化物稳定 | |
| B. | 原子半径大小顺序是X>Y>R | |
| C. | Y、R形成的化台物YR3能使酸性KMnO4溶液褪色 | |
| D. | 四种元素中最高价氧化物的水化物的酸性最强的是Y |
5.下列叙述中,错误的是( )
| A. | 原子半径:Na>Mg>O | |
| B. | 13C和14C属于同位素 | |
| C. | 0族元素是同周期中非金属性最强的元素 | |
| D. | N和P属于第ⅤA族元素,HNO3酸性比H3PO4的强 |
2.已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质.下面给出14种元素的X的数值:
试结合元素周期律知识完成下列问题:
(1)根据上表给出的数据,简述主族元素的X的数值大小与元素的金属性或非金属性强弱之间的关系元素X的数值越大,元素的非金属性越强;
(2)简述第二周期元素(除惰性气体外)的X的数值大小与原子半径之间的关系原子半径越小,X的数值越大.
(3)某化合物分子中含有S-N键,你认为该共用电子对偏向于N原子(填元素符号).
(4)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的化学键一般为离子键;当小于1.7时,一般为共价键.试推断AlBr3中的化学键类型是共价键.
(5)上表中元素形成的AB型化合物中,离子性最强的是NaF.
| 元素 | H | Li | Be | B | C | O | F |
| X的数值 | 2.20 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 |
| 元素 | Na | Mg | Al | Si | P | S | Cl |
| X的数值 | 0.93 | 1.31 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)根据上表给出的数据,简述主族元素的X的数值大小与元素的金属性或非金属性强弱之间的关系元素X的数值越大,元素的非金属性越强;
(2)简述第二周期元素(除惰性气体外)的X的数值大小与原子半径之间的关系原子半径越小,X的数值越大.
(3)某化合物分子中含有S-N键,你认为该共用电子对偏向于N原子(填元素符号).
(4)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的化学键一般为离子键;当小于1.7时,一般为共价键.试推断AlBr3中的化学键类型是共价键.
(5)上表中元素形成的AB型化合物中,离子性最强的是NaF.
9.下列反应的有机产物中,一定不存在同分异构体的反应是( )
| A. | 1,3-丁二烯(CH2=CH-CH=CH2)与等物质的量的Br2发生加成反应 | |
| B. | 2-氯丁烷( )与NaOH乙醇溶液共热发生消去HCl分子的反应 )与NaOH乙醇溶液共热发生消去HCl分子的反应 | |
| C. | 甲苯在一定条件下与足量硝酸发生硝化反应 | |
| D. | 乙醇与HBr发生的取代反应 |
19. 体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是( )
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是( )
 体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是( )
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是( )| A. | 滴入酸性KMnO4溶液振荡,溶液颜色无变化 | |
| B. | 该物质与苯酚属于同系物 | |
| C. | 1mol该物质和H2反应时最多消耗H26 mol | |
| D. | 1mol该物质与浓溴水反应时最多消Br2 4mol |
6.向含有1mol配合物[Co(NH3)5Cl]Cl2的溶液中加入足量的硝酸银溶液,得到的沉淀物质的量为( )
| A. | 1mol | B. | 1.5mol | C. | 2mol | D. | 3mol |
3.下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同),原子结构示意图为 .元素⑩名称为溴在周期表中的位置第四周期第ⅦA族.
.元素⑩名称为溴在周期表中的位置第四周期第ⅦA族.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是 .
.
(3)用电子式表示元素④与⑥的化合物的形成过程: ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.
(4)表示①与⑦的化合物的电子式 ,该化合物是由极性共价键(填“极性”、“非极性”)键形成的.
,该化合物是由极性共价键(填“极性”、“非极性”)键形成的.
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是S2->Cl->O2-.
(6)④和③形成含有非极性共价键的离子化合物的电子式
(7)元素②的氢化物的结构式为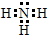 ;该氢化物常温下和元素②的最高价氧化物对应水化物反应的化学方程式为NH3+HNO3═NH4NO3.
;该氢化物常温下和元素②的最高价氧化物对应水化物反应的化学方程式为NH3+HNO3═NH4NO3.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .元素⑩名称为溴在周期表中的位置第四周期第ⅦA族.
.元素⑩名称为溴在周期表中的位置第四周期第ⅦA族.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是
 .
.(3)用电子式表示元素④与⑥的化合物的形成过程:
 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(4)表示①与⑦的化合物的电子式
 ,该化合物是由极性共价键(填“极性”、“非极性”)键形成的.
,该化合物是由极性共价键(填“极性”、“非极性”)键形成的.(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是S2->Cl->O2-.
(6)④和③形成含有非极性共价键的离子化合物的电子式

(7)元素②的氢化物的结构式为
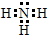 ;该氢化物常温下和元素②的最高价氧化物对应水化物反应的化学方程式为NH3+HNO3═NH4NO3.
;该氢化物常温下和元素②的最高价氧化物对应水化物反应的化学方程式为NH3+HNO3═NH4NO3.
4.某物质结构简式如图所示,下列有关该物质的说法不正确的是( )
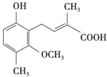

| A. | 该物质分子式为C13H16O4 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 在一定条件下可发生加成、取代、消去反应 | |
| D. | 1 mol该物质最多能与2mol NaOH反应 |