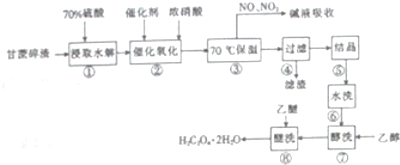
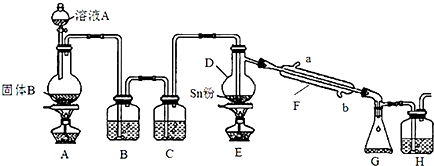
题目内容
3.某有机物A含有C、H、O三种元素,其蒸气密度是相同条件下H2密度的29倍,把1.16g该有机物在O2中充分燃烧,将生成物通过足量碱石灰,碱石灰增重3.72g,又知生成的CO2和H2O的物质的量之比为1:1.(1)有机物A的分子式C3H6O
(2)该有机物的红外光谱显示该分子是有一个羟基,无甲基的链状结构,请写出A的结构简式及名称CH2=CHCH2OH;丙烯醇.
分析 有机物A的相对分子质量=29×2=58,1.16g有机物A的物质的量=1.16g÷58g/mol=0.02mol,设1.16g有机物A燃烧生成CO2的为xmol,则H2O的也为xmol,故44x+18x=3.72,解得:x=0.06,故有机物分子C原子数目为 $\frac{0.06mol}{0.02mol}$=3、H原子数目为 $\frac{0.06mol×2}{0.02mol}$=6、O原子数目=$\frac{58-12×3-6}{16}$=1,则有机物分子式为C3H6O,该有机物分子有一个羟基,无甲基的链状结构,故有机物A的结构简式为:CH2=CHCH2OH.
解答 解:(1)有机物A的相对分子质量=29×2=58,1.16g有机物A的物质的量=1.16g÷58g/mol=0.02mol,设1.16g有机物A燃烧生成CO2的为xmol,则H2O的也为xmol,故44x+18x=3.72,解得:x=0.06,故有机物分子C原子数目为 $\frac{0.06mol}{0.02mol}$=3、H原子数目为 $\frac{0.06mol×2}{0.02mol}$=6、O原子数目=$\frac{58-12×3-6}{16}$=1,则有机物分子式为C3H6O,
故答案为:C3H6O;
(2)该有机物的分子式为C3H6O,分子有一个羟基,无甲基的链状结构,故有机物A的结构简式为:CH2=CHCH2OH,名称为丙烯醇,故答案为:CH2=CHCH2OH;丙烯醇.
点评 本题考查有机物化分子式确定及合成,关键根据燃烧法确定有机物分子组成,是高考中的常见题目,中等难度,试题基础性强,侧重对学生基础知识的巩固和训练,旨在考查学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案
相关题目
4.下列叙述一定正确的是( )
| A. | Na2CO3溶液加水稀释后,恢复至原温度,pH和KW均减小 | |
| B. | 常温下,pH=2的一元酸和pH=12的一元强碱等体积混合:C(OH-)=C(H+) | |
| C. | 0.1mol•L-1NaOH溶液分别中和pH、体积均相同的醋酸和盐酸,所消耗Na0H溶液的体积前者小于后者 | |
| D. | 0.1mol•L-1CH3COONa溶液和0.1mol•L-1CH3COOH溶液混合后溶液pH<7:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
5.下列表示物质的化学用语正确的是( )
| A. | 葡萄糖的分子式:C6H12O6 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 14C的原子结构示意图: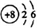 | D. | 氯气的电子式:Cl:Cl |
15.设NA为阿伏加德罗常数的值,下列说法正的是( )
| A. | 高温下,16.8 g Fe与足量水蒸气完全反应失去电子数为0.8 NA | |
| B. | 一定条件下Fe粉与足量的浓硫酸反应,转移电子数为3 NA | |
| C. | 在1 L的碳酸钠溶液中,若c(CO32- )=1 mol•L-1,则溶液中Na+的个数为2 NA | |
| D. | 含4 NA个离子的固体Na2O2溶于水配成1 L溶液,所得溶液中c(Na+)=2 mol•L-1 |
12.向某无色溶液中加入含Fe2+的溶液无明显变化,当滴加几滴稀H2SO4后,混合液出现红色,下列结论中错误的是( )
| A. | Fe2+被H2S04氧化成Fe3+ | |
| B. | 原无色溶液中一定含有SCN- | |
| C. | Fe2+与SCN-不能形成红色化合物 | |
| D. | 将稀H2SO4换成新制氯水,混合液也会出现红色 |