题目内容
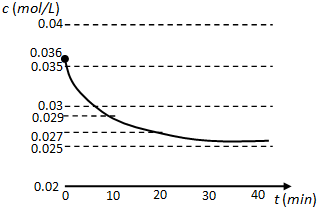
6.在一密闭的4L容器中装有2mol SO2和1mol O2,在一定条件下开始反应.2min末测得容器中有0.8mol SO2,请计算:(1)2min末SO3的浓度;
(2)2min内SO3的平均反应速率.
(3)2min末SO2的转化率.
分析 在一密闭的4L容器中装有2mol SO2和1mol O2,2min末测得容器中有0.8mol SO2,则:
2SO2(g)+O2(g)?2 SO3(g)
起始量(mol):2 1 0
变化量(mol):1.2 0.6 1.2
2min末(mol):0.8 0.4 1.2
(1)根据c=$\frac{n}{V}$计算SO3的浓度;
(2)根据v=$\frac{△c}{△t}$计算v(SO3);
(3)SO2的转化率=$\frac{反应二氧化硫物质的量}{二氧化硫起始物质的量}$×100%.
解答 解:在一密闭的4L容器中装有2mol SO2和1mol O2,2min末测得容器中有0.8mol SO2,则:
2SO2(g)+O2(g)?2 SO3(g)
起始量(mol):2 1 0
变化量(mol):1.2 0.6 1.2
2min末(mol):0.8 0.4 1.2
(1)2min末SO3的浓度为$\frac{1.2mol}{4L}$=0.3mol/L,
答:2min末SO3的浓度为0.3mol/L;
(2)2min内SO3的平均反应速率为$\frac{0.3mol/L}{2min}$=0.15mol/(L•min),
答:2min内SO3的平均反应速率为0.15mol/(L•min);
(3)2min末SO2的转化率为$\frac{1.2mol}{2mol}$×100%=60%,
答:2min末SO2的转化率为60%.
点评 本题考查化学平衡计算、反应速率计算,比较基础,有利于基础知识的巩固.

练习册系列答案
相关题目
8.下列关于化学用语叙述正确的是( )
| A. | H2O2的电子式: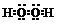 | |
| B. | 乙醇的结构式:C2H6O | |
| C. | 磷原子的结构示意图: | |
| D. | FeSO4 的电离方程式:FeSO4=Fe3++SO42ˉ |
5.下列表示物质的化学用语正确的是( )
| A. | 葡萄糖的分子式:C6H12O6 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 14C的原子结构示意图: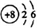 | D. | 氯气的电子式:Cl:Cl |
15.设NA为阿伏加德罗常数的值,下列说法正的是( )
| A. | 高温下,16.8 g Fe与足量水蒸气完全反应失去电子数为0.8 NA | |
| B. | 一定条件下Fe粉与足量的浓硫酸反应,转移电子数为3 NA | |
| C. | 在1 L的碳酸钠溶液中,若c(CO32- )=1 mol•L-1,则溶液中Na+的个数为2 NA | |
| D. | 含4 NA个离子的固体Na2O2溶于水配成1 L溶液,所得溶液中c(Na+)=2 mol•L-1 |
16.不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是( )
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | 石灰水 |
| ② | CO2 | NH3 | CaCl2 |
| ③ | HCl | CO2 | 石灰水 |
| ④ | CO2 | SO2 | Ba(NO3)2 |
| ⑤ | NO2 | SO2 | BaCl2 |
| ⑥ | NH3 | CO2 | NaCl |
| A. | ②③④ | B. | ①③④⑤ | C. | ①③④⑤⑥ | D. | ①②③④ |
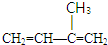 或
或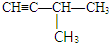 .
.