题目内容
7.用NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 含1mol H2SO4的浓硫酸与足量铜反应转移的电子总数为2NA | |
| B. | 标准状况下,22.4LO2作氧化剂时转移电子数一定为4NA | |
| C. | 10L0.1mol•L-1的Na2CO3溶液中,Na+、CO32-总数为3NA | |
| D. | 通常状况下,4.2g丙烯中所含碳氢键数目为0.6NA |
分析 A、铜只能与浓硫酸反应,与稀硫酸不反应;
B、氧气反应后可能变为-1价或-2价;
C、CO32-为弱酸根,在溶液中会水解;
D、求出丙烯的物质的量,然后根据1mol丙烯中含6molC-H键来分析.
解答 解:A、铜只能与浓硫酸反应,与稀硫酸不反应,故1mol硫酸不能完全反应,则转移的电子数小于2NA个,故A错误;
B、氧气反应后可能变为-1价或-2价,故1mol氧气转移电子数可能为2NA个,也可能为4NA个,故B错误;
C、CO32-为弱酸根,在溶液中会水解,故溶液中的Na+、CO32-总数小于3NA个,故C错误;
D、4.2g丙烯的物质的量为0.1mol,而1mol丙烯中含6molC-H键,故0.1mol丙烯中含0.6molC-H即0.6NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案
相关题目
8.下列关于化学用语叙述正确的是( )
| A. | H2O2的电子式: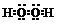 | |
| B. | 乙醇的结构式:C2H6O | |
| C. | 磷原子的结构示意图: | |
| D. | FeSO4 的电离方程式:FeSO4=Fe3++SO42ˉ |
15.设NA为阿伏加德罗常数的值,下列说法正的是( )
| A. | 高温下,16.8 g Fe与足量水蒸气完全反应失去电子数为0.8 NA | |
| B. | 一定条件下Fe粉与足量的浓硫酸反应,转移电子数为3 NA | |
| C. | 在1 L的碳酸钠溶液中,若c(CO32- )=1 mol•L-1,则溶液中Na+的个数为2 NA | |
| D. | 含4 NA个离子的固体Na2O2溶于水配成1 L溶液,所得溶液中c(Na+)=2 mol•L-1 |
2.受日本福岛核电站核泄漏的影响,浙江、江苏等13个省、自治区和直辖市空气中稀先后监测到微量的人工放射性核素铯-137和铯-134.铯的相关信息如下表,下面对铯-137和铯-134说法错误的是( )
| 元素符号:Cs 中文名称:铯 英文名称:Cesium 原子序数:55 相对原子质量:132.9 核外电子排布:2,8,18,18,8,1 |
| A. | 两者互为同位素 | |
| B. | 两者原子核内中子数相差3 | |
| C. | 两者氯化物的化学式都可以表示为CsCl2 | |
| D. | Cs元素位于周期表第六周期 |
12.向某无色溶液中加入含Fe2+的溶液无明显变化,当滴加几滴稀H2SO4后,混合液出现红色,下列结论中错误的是( )
| A. | Fe2+被H2S04氧化成Fe3+ | |
| B. | 原无色溶液中一定含有SCN- | |
| C. | Fe2+与SCN-不能形成红色化合物 | |
| D. | 将稀H2SO4换成新制氯水,混合液也会出现红色 |
16.不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是( )
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | 石灰水 |
| ② | CO2 | NH3 | CaCl2 |
| ③ | HCl | CO2 | 石灰水 |
| ④ | CO2 | SO2 | Ba(NO3)2 |
| ⑤ | NO2 | SO2 | BaCl2 |
| ⑥ | NH3 | CO2 | NaCl |
| A. | ②③④ | B. | ①③④⑤ | C. | ①③④⑤⑥ | D. | ①②③④ |