题目内容
11.下列过程中没有发生化学反应的是( )| A. | 用活性炭去除汽车内室的异味 | |
| B. | 用硝酸对钢船舱进行钝化处理 | |
| C. | 用经硫酸酸化处理的三氧化铬硅胶检验酒精 | |
| D. | 用小苏打溶水拌入面中一起蒸煮使馒头蓬松 |
分析 化学变化是指有新物质生成的变化,物理变化是指没有新物质生成的变化,化学变化和物理变化的本质区别是否有新物质生成,据此分析判断.
解答 解:A、用活性炭去除冰箱中的异味:利用活性炭的吸附作用,属于物理变化,没有发生化学变化,故A正确;
B、常温下,Fe、Al遇浓硝酸发生钝化,在金属的表面生成一层致密的氧化物,有新物质生成,是化学变化,故B错误;
C、CrO3变为绿色的Cr2(SO4)3化合价降低,将乙醇氧化属于化学变化,故C错误;
D、蒸馒头过程中,小苏打受热分解产生碳酸钠、二氧化碳和水,属于化学变化,故D错误,故选A.
点评 本题考查物理变化与化学变化的判断,难度不大.要注意化学变化和物理变化的本质区别是否有新物质生成.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.${\;}_{27}^{61}$Co原子的核内中子数为( )
| A. | 61 | B. | 27 | C. | 88 | D. | 34 |
2.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的离子方程式有Zn+Cu2+=Zn2++Cu、Zn+2H+=Zn2++H2↑;
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在Zn表面,降低了Zn与溶液接触的表面,使得氢气的生成速率反而下降;
(3)改用锌粉与稀硫酸反应,加入少量硫酸铜溶液后充分振荡,一段时间剩余少量固体.该同学对固体成分提出下列假设:
假设1:全部为铜;
假设2:既有Zn又有Cu.
(4)请你设计实验验证上述假设1,完成下表内容.
(1)上述实验中发生反应的离子方程式有Zn+Cu2+=Zn2++Cu、Zn+2H+=Zn2++H2↑;
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 | A | B | C | D | E | F | |
| 混 合 溶 液 | 4mol/LH2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 | |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 | |
| 时间(min) | 15 | 10 | 5 | 3 | 6 | 9 | |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在Zn表面,降低了Zn与溶液接触的表面,使得氢气的生成速率反而下降;
(3)改用锌粉与稀硫酸反应,加入少量硫酸铜溶液后充分振荡,一段时间剩余少量固体.该同学对固体成分提出下列假设:
假设1:全部为铜;
假设2:既有Zn又有Cu.
(4)请你设计实验验证上述假设1,完成下表内容.
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| , |
6.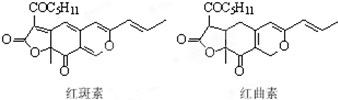 着色剂为使食品着色的物质,可增加对食品的嗜好及刺激食欲.红斑素、红曲素是常用于糖果、雪糕等食品的着色剂的主要成分,结构如图所示.下列说法正确的是( )
着色剂为使食品着色的物质,可增加对食品的嗜好及刺激食欲.红斑素、红曲素是常用于糖果、雪糕等食品的着色剂的主要成分,结构如图所示.下列说法正确的是( )
 着色剂为使食品着色的物质,可增加对食品的嗜好及刺激食欲.红斑素、红曲素是常用于糖果、雪糕等食品的着色剂的主要成分,结构如图所示.下列说法正确的是( )
着色剂为使食品着色的物质,可增加对食品的嗜好及刺激食欲.红斑素、红曲素是常用于糖果、雪糕等食品的着色剂的主要成分,结构如图所示.下列说法正确的是( )| A. | 红斑素和红曲素互为同分异构体 | |
| B. | 一定条件下红斑素和红曲素都能发生加聚和缩聚反应 | |
| C. | 红斑素中含有醚键、羰基、酯键这三种含氧官能团 | |
| D. | 1 mol红曲素最多能与6 mol H2发生加成反应 |
16. 一定温度和电压下,电解精制食盐水可制取NaClO3.电解装置如图.已知:3Cl2+6OH-=ClO3-+5Cl-+3H2O.下列说法正确的是( )
一定温度和电压下,电解精制食盐水可制取NaClO3.电解装置如图.已知:3Cl2+6OH-=ClO3-+5Cl-+3H2O.下列说法正确的是( )
 一定温度和电压下,电解精制食盐水可制取NaClO3.电解装置如图.已知:3Cl2+6OH-=ClO3-+5Cl-+3H2O.下列说法正确的是( )
一定温度和电压下,电解精制食盐水可制取NaClO3.电解装置如图.已知:3Cl2+6OH-=ClO3-+5Cl-+3H2O.下列说法正确的是( )| A. | 铁为阳极,电极反应式为2H2O+2e-=H2↑+2OH- | |
| B. | 若阴极产生3.36L(标况)气体,则溶液中的反应转移电子0.30mol | |
| C. | 电解槽内总反应方程式为:NaCl+3H2O $\frac{\underline{\;通电\;}}{\;}$NaClO3+3H2↑ | |
| D. | 用阳离子交换膜代替阴离子交换膜,也一样可以制得NaClO3 |
3.离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝.下列电解原理正确的是( )
| A. | 钢制品应接电源的正极 | |
| B. | 电镀时铝作阳极,阳极反应式为Al-3e-+7AlCl4-=4Al2Cl7- | |
| C. | 电解液中H+移向阴极,OH-移向阳极 | |
| D. | 每生成1mol铝,电解液中转移3mol电子 |
 ;
;
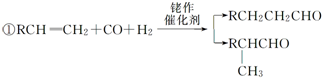
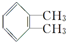 ,名称为邻二甲苯.
,名称为邻二甲苯.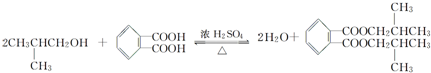 .
.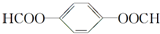 ;X分子中有2种不同化学环境的氢原子,其峰面积之比为1:2;1mol X与NaOH溶液共热反应,最多消耗4 mol NaOH.
;X分子中有2种不同化学环境的氢原子,其峰面积之比为1:2;1mol X与NaOH溶液共热反应,最多消耗4 mol NaOH.