题目内容
7.某能使石蕊试液变红的溶液中,能大量存在的离子是( )| A. | Al3+ NH4+ SO42-Cl- | B. | Na+Mg2+ HCO3- NO3- | ||
| C. | K+ Na+ AlO2-Cl- | D. | Fe2+ K+NO3-Cl- |
分析 能使石蕊试液变红的溶液,显酸性,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:A.酸性溶液中该组离子之间不反应,可大量共存,故A正确;
B.H+、HCO3-结合生成水和气体,不能大量共存,故B错误;
C.H+、AlO2-结合生成沉淀,不能大量共存,故C错误;
D.Fe2+、NO3-、H+发生氧化还原反应,不能大量共存,故D错误;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的隐含信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
17.下列描述中,不符合生产实际的是( )
| A. | 工业电解饱和食盐水,阳离子交换膜的作用是使得阴极区的OH -不能进入阳极区 | |
| B. | 电解法精炼铜用纯铜作阴极,阳极泥中可能含有金、银等贵重金属. | |
| C. | 在镀件上电镀锌,用锌作阳极 | |
| D. | 电解熔融的氧化铝制取金属铝,用铁作阳极 |
18.元素R的阴离子Rn-核外有x个电子,其核内的中子数为m,则R的质量数是( )
| A. | x-n | B. | m-x+n | C. | m+x-n | D. | x+n |
15.下列物质的制备方法正确的是( )
| A. | 用铝粉和MnO2制得锰 | |
| B. | 用电解熔融氯化铝的方法制得单质铝 | |
| C. | 氯化铝溶液和过量氢氧化钠溶液反应制备Al(OH)3 | |
| D. | 用镁粉和空气反应制备Mg3N2 |
2.下列表述中正确的是( )
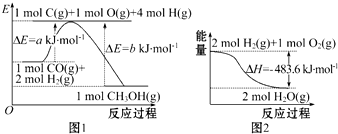

| A. | 根据图1可知合成甲醇的热化学方程式为CO(g)+2H2(g)═CH3OH(g)△H1=(b-a)kJ•mol-1 | |
| B. | 1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,后者比前者△H小 | |
| C. | 图2表示2 mol H2(g)所具有的能量比2 mol气态水所具有的能量多483.6 kJ | |
| D. | 汽油燃烧时将全部的化学能转化为热能 |
12.某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )
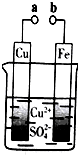

| A. | 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 | |
| B. | a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动 | |
| C. | a和b不连接时,铁片上会有金属铜析出 | |
| D. | a和b用导线连接时,外电路中每通过0.1mol电子,铜的质量理论上增加3.2g |
19.下列说法错误的是( )
| A. | 苯、四氯化碳用溴水即可鉴别 | |
| B. | CH3CH2OH、CH3COOH均可与金属Na反应生成H2 | |
| C. | 糖类、蛋白质、油脂都能发生水解反应 | |
| D. | 等物质的量的乙烯、乙醇分别完全燃烧,消耗O2的质量相等 |
17.用下列实验装置进行的实验中,能达到相应实验目的是( )
| A. | 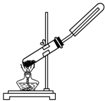 用氯化铵和氢氧化钙固体制NH3 | |
| B. | 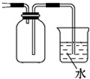 收集NH3并吸收尾气 | |
| C. | 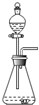 用H2O2和MnO2制取O2 | |
| D. | 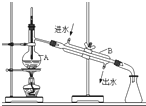 用蒸馏法分离沸点不同且互溶的液体混合物 |
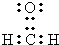 .A中所有原子是否共面是(填“是”或“否”).
.A中所有原子是否共面是(填“是”或“否”).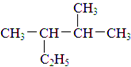 :2,3-二甲基戊烷;②
:2,3-二甲基戊烷;②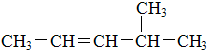 :4-甲基-2-戊烯.
:4-甲基-2-戊烯.