题目内容
【题目】氮的单质及其化合物性质多样,用途广泛。完成下列填空:
科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2:2NO+2CO![]() 2CO2+N2+Q(Q>0)。
2CO2+N2+Q(Q>0)。
在某温度下测得该反应在不同时间的CO浓度如下表:
浓度(mol/L) 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(CO) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)该反应平衡常数K的表达式为___;温度升高,K值___(选填“增大”“减小”“不变”);前2s的平均反应速率v(N2)=___;若上诉反应在密闭容器中发生,达到平衡时能提高NO转化率的措施之一是___。
(2)工业合成氨的反应温度选择500℃左右的原因是___。
(3)实验室在固定容积的密闭容器中加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是___。
A.N2、H2、NH3的浓度之比为1:3:2
B.容器内的压强保持不变
C.N2、H2、NH3的浓度不在变化
D.反应停止,正、逆反应的速率都等于零
(4)常温下向1molHCl的稀盐酸中缓缓通入1molNH3(溶液体积变化忽略不计),反应结束后溶液中离子浓度由大到小的顺序是___;在通入NH3的过程中溶液的导电能力___(选填“变大”“变小”“几乎不变”)
【答案】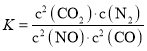 减小 1.875×10-4mol/(L·s) 增大压强(或其它合理答案) 催化剂在500℃左右具有最佳活性 BC c(Cl-)> c(NH4+)>c(H+)>c(OH-) 几乎不变
减小 1.875×10-4mol/(L·s) 增大压强(或其它合理答案) 催化剂在500℃左右具有最佳活性 BC c(Cl-)> c(NH4+)>c(H+)>c(OH-) 几乎不变
【解析】
(1)根据平衡常数和化学反应速率(![]() )的相关公式进行计算;
)的相关公式进行计算;
(2)工业合成氨的反应温度选择500℃左右的主要原因是催化剂在500℃左右具有最佳活性;
(3)根据化学平衡状态的特征判断,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(4)二者恰好反应生成氯化铵,水解方程式为NH4++H2O![]() NH3.H2O+H+,溶液呈酸性,进行分析。
NH3.H2O+H+,溶液呈酸性,进行分析。
(1)平衡常数等于生成物浓度的系数次幂之积除以反应浓度系数次幂之积,根据反应2NO(g)+2CO(g)![]() 2CO2(g)+N2 (g) ,平衡常数
2CO2(g)+N2 (g) ,平衡常数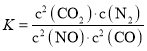 ;该反应为放热反应,温度升高时平衡逆向移动,所以平衡常数减小;根据速率之比等于各物质系数比可知:v(CO)=
;该反应为放热反应,温度升高时平衡逆向移动,所以平衡常数减小;根据速率之比等于各物质系数比可知:v(CO)= ![]() ,前2s内的平均反应速率v(N2)=v(CO)/2=1.875×10-4 mol/(L·s);一氧化氮的转化率变大,说明平衡正向移动可以通过增大压强,使平衡正向移动,故答案为:
,前2s内的平均反应速率v(N2)=v(CO)/2=1.875×10-4 mol/(L·s);一氧化氮的转化率变大,说明平衡正向移动可以通过增大压强,使平衡正向移动,故答案为: 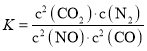 ;减小;1.875×10-4mol/(L·s);增大压强(或其它合理答案);
;减小;1.875×10-4mol/(L·s);增大压强(或其它合理答案);
(2)工业合成氨的反应温度选择500℃左右的主要原因是催化剂在500℃左右具有最佳活性,故答案为:催化剂在500℃左右具有最佳活性;
(3) A. 浓度之比为1:3:2,并不是不变,不能判断是否平衡,A项错误;
B. 反应正向进行,体积减小,当压强不变时,已经到达平衡,B项正确;
C.N2、H2、NH3的浓度不再变化,已经到达平衡,C项正确;
D. 可逆反应达到平衡时,正、逆反应的速率相等,但不会等于零,D项错误;故答案为:BC;
(4)二者恰好反应生成氯化铵,水解方程式为NH4++H2O![]() NH3.H2O+H+,溶液呈酸性,即c(H+)>c(OH-),根据溶液呈电中性有: c(NH4+)+c(H+)=c(OH-)+ c(Cl-),因为c(H+)>c(OH-),所以c(Cl-)> c(NH4+),故离子浓度大小关系为: c(Cl-)> c(NH4+)>c(H+)>c(OH-);溶液中离子浓度几乎不变,所以导电能力几乎不变,故答案为:c(Cl-)> c(NH4+)>c(H+)>c(OH-);几乎不变。
NH3.H2O+H+,溶液呈酸性,即c(H+)>c(OH-),根据溶液呈电中性有: c(NH4+)+c(H+)=c(OH-)+ c(Cl-),因为c(H+)>c(OH-),所以c(Cl-)> c(NH4+),故离子浓度大小关系为: c(Cl-)> c(NH4+)>c(H+)>c(OH-);溶液中离子浓度几乎不变,所以导电能力几乎不变,故答案为:c(Cl-)> c(NH4+)>c(H+)>c(OH-);几乎不变。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案【题目】碳酸氢纳俗称“小苏打”,是氨碱法和联合制碱法制纯碱的中间产物,可用作膨松剂,制酸剂,灭火剂等。工业上用纯碱溶液碳酸化制取碳酸氢钠。
(1)某碳酸氢钠样品中含有少量氯化钠。称取该样品,用0.1000mol/L盐酸滴定,耗用盐酸20.00mL。若改用0.05618mol/L硫酸滴定,需用硫酸____________mL(保留两位小数)。
(2)某溶液组成如表一:
化合物 | Na2CO3 | NaHCO3 | NaCl |
质量(kg) | 814.8 | 400.3 | 97.3 |
问该溶液通入二氧化碳,析出碳酸氢钠晶体。取出晶体后溶液组成如表二:
化合物 | Na2CO3 | NaHCO3 | NaCl |
质量(kg) | 137.7 | 428.8 | 97.3 |
计算析出的碳酸氢钠晶体的质量(保留1位小数)。____________
(3)将组成如表二的溶液加热,使碳酸氢钠部分分解,溶液中NaHCO3的质量由428.8kg降为400.3kg,补加适量碳酸钠,使溶液组成回到表一状态。计算补加的碳酸钠质量(保留1位小数)。____________
(4)某种由碳酸钠和碳酸氢钠组成的晶体452kg溶于水,然后通入二氧化碳,吸收二氧化碳44.8×103L(标准状况),获得纯的碳酸氢钠溶液,测得溶液中含碳酸氢钠504kg。通过计算确定该晶体的化学式____________
【题目】新型储氢材料是开发利用氢能的重要研究方向。
(1)元素N的价电子数排布式为3d24s2,其氯化物NCl4和LiBH4反应可制得储氢材料N(BH4)3。
①元素N在周期表中的位置为__,该原子具有__种运动状态不同的电子。
②化合物LiBH4中含有的化学键有__,BH4-的立体构型是_,B原子的杂化轨道类型是__,B原子轨道表达式为__。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+__H-(填“>”“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:M的最高正价是__。
I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 | I5/kJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
(3)NaH具有NaCl型晶体结构,Na+的配位数为__,晶体的堆积方式为__,已知NaH晶体的晶胞参数a=488pm,Na+半径为102pm,H-的半径为pm,NaH的理论密度是__g·cm-3。(仅写表达式,不计算)