题目内容
【题目】某二元酸(化学式用H2B表示)在水中的电离方程式:H2B=H++HB-,HB-![]() H++B2-,则在0.1mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是( )
H++B2-,则在0.1mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是( )
A.c(B2-)+c(HB-)+c(H2B)=0.1mol·L-1
B.c(OH-)=c(H+)+c(HB-)+2c(H2B)
C.c(Na+)=2c(B2-)+2c(HB-)
D.c(Na+)+c(H+)=c(OH-)+c(HB-)+c(B2-)
【答案】C
【解析】
H2B第一步完全电离、第二步部分电离,则HB-只能电离不能水解,说明B2-离子水解而HB-不水解,且HB-是弱酸,则Na2B溶液呈碱性;任何电解质溶液中都存在电荷守恒和物料守恒,据此分析解答。
H2B第一步完全电离、第二步部分电离,则HB-只能电离不能水解,说明B2-离子水解而HB-不水解,且HB-是弱酸,则Na2B溶液呈碱性。
A.H2B第一步完全电离,所以溶液中不存在H2B,则c(H2B)=0,根据原子守恒应该为c(B2-)+c(HB- )=0.1mol·L-1,故A错误;
B. H2B第一步完全电离,所以溶液中不存在H2B,溶液中存在质子守恒,根据质子守恒得:c(OH-)=c(H+)+c(HB-),故B错误;
C. 根据物料守恒得c(Na+)=2c(B2- )+2c(HB- ),故C正确;
D. 根据电荷守恒得:c(Na+)+c(H+ )=c(OH- )+c(HB-)+2c(B2- ),故D错误;
故选C。

【题目】氮的单质及其化合物性质多样,用途广泛。完成下列填空:
科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2:2NO+2CO![]() 2CO2+N2+Q(Q>0)。
2CO2+N2+Q(Q>0)。
在某温度下测得该反应在不同时间的CO浓度如下表:
浓度(mol/L) 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(CO) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)该反应平衡常数K的表达式为___;温度升高,K值___(选填“增大”“减小”“不变”);前2s的平均反应速率v(N2)=___;若上诉反应在密闭容器中发生,达到平衡时能提高NO转化率的措施之一是___。
(2)工业合成氨的反应温度选择500℃左右的原因是___。
(3)实验室在固定容积的密闭容器中加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是___。
A.N2、H2、NH3的浓度之比为1:3:2
B.容器内的压强保持不变
C.N2、H2、NH3的浓度不在变化
D.反应停止,正、逆反应的速率都等于零
(4)常温下向1molHCl的稀盐酸中缓缓通入1molNH3(溶液体积变化忽略不计),反应结束后溶液中离子浓度由大到小的顺序是___;在通入NH3的过程中溶液的导电能力___(选填“变大”“变小”“几乎不变”)
【题目】下列对有关微粒的相互关系和特征描述正确的是( )
选项 | 微粒 | 相互关系 | 特征描述 |
A | C60、C70、C540 | 同位素 | 微粒中只含非极性共价键 |
B | 新烷、2,2﹣二甲基丙烷 | 同分异构体 | 常温常压下呈气态 |
C |
| 同素异形体 | 铂作氨催化氧化时的催化剂 |
D | 甲酸、硬脂酸 | 同系物 | 能发生酯化反应 |
A. A B. B C. C D. D
【题目】某研究性学习小组探究FeSO4的化学性质和用途。回答下列问题:
(一) 探究FeSO4溶液的酸碱性:
(1)取少量FeSO4固体,利用石蕊试液测试FeSO4溶液的酸碱性,必须选用的仪器有胶头滴管、药匙和_____________。
A.玻璃棒 B.试管 C.天平 D.量筒
(二)利用下图装置探究FeSO4的稳定性
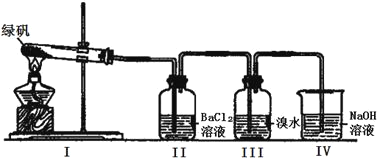
(2)II中有白色沉淀生成,小组成员结合理论分析,认为下列分解产物不可能的是_____________。
A.Fe2O3、SO3、H2O
B.Fe2O3、SO2、SO3、H2O
C.FeO、Fe2O3、SO2、SO3、H2O
(3)III中溴水是用来检验是否有SO2气体生成,若有SO2生成,溴水将褪色。实验中,观察到溴水褪色,据此推测FeSO4分解最有可能被氧化的元素是_______。
(4)NaOH的作用是吸收SO2气体,请写出最大量吸收SO2气体的反应化学方程式:_________。
(三)探究FeSO4中Fe2+还原性:
(5)证明FeSO4有较强的还原性,完成下表。
实验步骤 | 实验预期现象及结论 |
步骤一:取少量的FeSO4固体于试管中,加入一定量水溶解。 |
_________________________ |
步骤二:______________ |
(四)硫酸亚铁用途探究
(6)缺铁性贫血往往口服硫酸亚铁,当用硫酸亚铁制成药片时,外表包有一层特殊的糖衣,其作用是__________________。