题目内容
10.短周期四种元素离子W2+、X-、Y2-、Z+的电子层结构相同.下列说法正确的是( )| A. | 氢氧化物碱性强弱:W(OH)2>ZOH | |
| B. | 原子序数:W>Z>X>Y | |
| C. | Y的气态氢化物比X的气态氢化物稳定 | |
| D. | 离子半径:r(W2+)>r(X-)>r(Y2-)>r(Z+) |
分析 短周期四种元素离子W2+、X-、Y2-、Z+的电子层结构相同,结合离子所带电荷可知,W为Mg、X为F、Y为O、Z为Na.
A.金属性越强,最高价氧化物对应水化物的碱性越强;
B.W为Mg、X为F、Y为O、Z为Na,原子序数分别为12、9、8、11;
C.非金属性越强,氢化物越稳定;
D.电子层结构相同,核电荷数越大,离子半径越小.
解答 解:短周期四种元素离子W2+、X-、Y2-、Z+的电子层结构相同,结合离子所带电荷可知,W为Mg、X为F、Y为O、Z为Na.
A.金属性Na>Mg,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性:Mg(OH)2<NaOH,故A错误;
B.W为Mg、X为F、Y为O、Z为Na,原子序数分别为12、9、8、11,原子序数:W>Z>X>Y,故B正确;
C.非金属性F>O,非金属性越强,氢化物越稳定,故氢化物稳定性HF>H2O,故C错误;
D.电子层结构相同,核电荷数越大,离子半径越小,故离子半径r(O2-)>r(F-)r(Na+)>r(Mg2+),故D错误,
故选B.
点评 本题考查结构性质位置关系应用,注意根据短周期元素离子具有相同电子层结构推断元素,同时判断元素相对位置,再利用元素周期律解答问题,知道离子半径大小比较方法.

练习册系列答案
相关题目
20.X、Y、Z、M、Q是中学化学常见的五种元素,原子序数依次增大,其结构或性质信息如下表
(1)Q元素基态原子的电子排布式是1s22s22p63s23p63d64s2.
(2)比较Y元素与氧元素的第一电离能N>O;X和Z形成的化合物XZ2为一种液体溶剂,其分子中的σ键和π键数目之比为1:1.
(3)写出实验室制备M单质的离子方程式MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O.
(4)M的气态氢化物和氟化氢相比(写化学式)
稳定性强的是HF,其原因是因为元素非金属性F>Cl,所以HF稳定;
沸点高的是HF,其原因是因为HF分子之间存在氢键,所以HF沸点高.
| 元素 | 结构或性质信息 |
| X | 其原子最外层电子数是内层电子数的2倍 |
| Y | 基态原子最外层电子排布为nsnnpn+1 |
| Z | 非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰 |
| M | 单质在常温、常压下是气体.基态原子的M层上有1个未成对的p电子 |
| Q | 其与X形成的合金为目前用量最多的金属材料 |
(2)比较Y元素与氧元素的第一电离能N>O;X和Z形成的化合物XZ2为一种液体溶剂,其分子中的σ键和π键数目之比为1:1.
(3)写出实验室制备M单质的离子方程式MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O.
(4)M的气态氢化物和氟化氢相比(写化学式)
稳定性强的是HF,其原因是因为元素非金属性F>Cl,所以HF稳定;
沸点高的是HF,其原因是因为HF分子之间存在氢键,所以HF沸点高.
1.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 78 g苯含有C=C键的数目为3 NA | |
| C. | 常温常压下,14 g由N2和CO组成的混合气体含有的电子总数为7 NA | |
| D. | 1 mol FeI2与足量氯气反应时转移的电子数为2 NA |
5.将4.48g Fe溶于1L 0.2mol/L的稀硫酸,再加入50mL 0.4mol/L KNO3溶液后,其中的Fe2+全部转化成Fe3+,NO${\;}_{3}^{-}$也完全反应,生成一种氮氧化物NyOx,则该氮氧化物的化学式是( )
| A. | N2O | B. | NO | C. | N2O5 | D. | NO2 |
15.下列实验操作正确的是( )
| A. |  称取食盐 | B. |  稀释浓硫酸 | C. |  检查气密性 | D. |  点燃酒精灯 |
2.在一个密闭的容器内有四种物质,高温下发生反应,一段时间后测得反应前后各物质的质量如下:
若a的相对分子质量为2n,d的相对分子质量为3n,则该反应的化学方程式中a与d的化学计量数比为( )
| a | b | c | d | |
| 反应前质量(g) | 8 | 10 | 1 | 25 |
| 反应后质量(g) | 未测 | 24 | 2 | 16 |
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:3 |
20.将锌片和铜片按图示方式插入柠檬中,电流计指针发生偏转.下列针对该装置的说法正确的是( )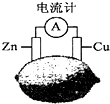

| A. | 将电能转换为化学能 | B. | 电子由铜片流出经导线到锌 | ||
| C. | 一段时间后,锌片质量减轻 | D. | 铜片一侧柠檬变蓝色,产生Cu2+ |
 有A、B、C、B、D、E五种元素,B原子得到一个电子后3P轨道全充满,A+比B形成的简单离子少一个电子层,C原子的P轨道半充满,它形成的氢化物的沸点是同主族元素的氢化物中最低的,D和E是位于同一主族的短周期元素,E元素的最高化合价与最低化合价的代数和为零,E在其最高价氧化物中的质量分数为46.67%.请回答:
有A、B、C、B、D、E五种元素,B原子得到一个电子后3P轨道全充满,A+比B形成的简单离子少一个电子层,C原子的P轨道半充满,它形成的氢化物的沸点是同主族元素的氢化物中最低的,D和E是位于同一主族的短周期元素,E元素的最高化合价与最低化合价的代数和为零,E在其最高价氧化物中的质量分数为46.67%.请回答: