题目内容
5.将4.48g Fe溶于1L 0.2mol/L的稀硫酸,再加入50mL 0.4mol/L KNO3溶液后,其中的Fe2+全部转化成Fe3+,NO−3也完全反应,生成一种氮氧化物NyOx,则该氮氧化物的化学式是( )| A. | N2O | B. | NO | C. | N2O5 | D. | NO2 |
分析 Fe与硫酸反应,生成硫酸亚铁,硫酸有剩余,再加入50mL 0.4mol•L-1KNO3溶液后,其中的Fe2+全部转化成Fe3+,NO3-也完全反应,根据电子转移守恒计算N元素在还原产物中的化合价,进而确定生成的氮的氧化物.
解答 解:4.48gFe的物质的量=4.48g56g/mol=0.08mol,1L 0.2mol•L-1的稀硫酸中硫酸的物质的量=1L×0.2mol•L-1=0.2mol,由Fe+H2SO4=FeSO4+H2↑可知,硫酸有剩余,故溶液中n(Fe2+)=n(Fe)=0.08mol,再加入50mL 0.4mol•L-1KNO3溶液后,其中的Fe2+全部转化成Fe3+,NO3-也完全反应,生成一种氮氧化物NYOX,令N元素在氧化物中的化合价为a,根据电子转移守恒可知:0.08mol×(3-2)=0.05L×0.4mol/L×(5-a),解得a=1,故该氧化物的化学式为N2O,
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及电子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
15.25℃时,下列分子或离子在指定的分散系中能大量共存的一组是( )
| A. | 空气 SO2、NO、NO2、CO | |
| B. | 碱性溶液 Na+、K+、NO3-、CO32- | |
| C. | 酸性溶液 Na+、ClO-、SO42-、SiO32- | |
| D. | KNO3溶液 Fe2+、H+、Cl-、Cu2+ |
20.化学与人类生活、社会可持续发展密切相关.下列有关说法不正确的是( )
| A. | “静电除尘”、“汽车尾气的催化净化”都有利于提高空气的质量 | |
| B. | 减少化石燃料的使用,有利于降低空气中PM2.5的含量 | |
| C. | 石油的分馏是获得芳香烃的主要途径 | |
| D. | 医用酒精是用淀粉类植物发酵经蒸馏、加工制成,浓度通常是75% |
10.短周期四种元素离子W2+、X-、Y2-、Z+的电子层结构相同.下列说法正确的是( )
| A. | 氢氧化物碱性强弱:W(OH)2>ZOH | |
| B. | 原子序数:W>Z>X>Y | |
| C. | Y的气态氢化物比X的气态氢化物稳定 | |
| D. | 离子半径:r(W2+)>r(X-)>r(Y2-)>r(Z+) |
17.化学现象中有许多“相等”,下列有关“相等”的说法,错误的是( )
| A. | 原子中核内质子数和核外电子数一定相等 | |
| B. | 中和反应中参加反应的酸和碱质量一定相等 | |
| C. | 溶液稀释前后溶质的质量一定相等 | |
| D. | 物质发生化学变化前后,质量总和一定相等 |
14.下列说法正确的是( )
| A. | 当今化学研究的方向是研究化学反应中原子的守恒关系 | |
| B. | 光导纤维由硅晶体制成,具有耐腐蚀、传输能力强等特点 | |
| C. | 煤在燃烧过程中要放出大量SO2,是引起光化学烟雾的“罪魁祸首” | |
| D. | 禽流感并不可怕,当加热到70℃以上或使用日常消毒剂都可使其病毒蛋白变性而致死 |
15.下列化学用语正确的是( )
| A. | 氯化钠的电子式: | |
| B. | 聚氯乙烯的结构简式: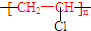 | |
| C. | 硫离子的结构示意图: | |
| D. | 碳酸氢铵的电离方程式:NH4HCO3=NH4++H++CO32ˉ |