题目内容
18. 有A、B、C、B、D、E五种元素,B原子得到一个电子后3P轨道全充满,A+比B形成的简单离子少一个电子层,C原子的P轨道半充满,它形成的氢化物的沸点是同主族元素的氢化物中最低的,D和E是位于同一主族的短周期元素,E元素的最高化合价与最低化合价的代数和为零,E在其最高价氧化物中的质量分数为46.67%.请回答:
有A、B、C、B、D、E五种元素,B原子得到一个电子后3P轨道全充满,A+比B形成的简单离子少一个电子层,C原子的P轨道半充满,它形成的氢化物的沸点是同主族元素的氢化物中最低的,D和E是位于同一主族的短周期元素,E元素的最高化合价与最低化合价的代数和为零,E在其最高价氧化物中的质量分数为46.67%.请回答:(1)元素X与B、C均相邻,比较X、C元素的第一电离能>.
(2)C元素氢化物分子中心原子的杂化方式为sp3.
(3)D的最高氧化物是非极性分子(填“极性”或“非极性”).
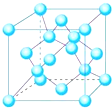
(4)镧镍合金、铜钙合金及铈钴合金都具有相同类型的晶胞结构XY,它们有很强的储氢能力,其中镧镍合金的晶胞结构如图.
①写出Ni2+的核外电子排布式1s22s22p63s23p63d8.
②已知镧镍合金LaNi,晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5的合金(氢进入晶胞空隙,体积不变),则LaNin中n=5(填数值);氢在合金中的密度为0.25g•cm-3.
分析 有A、B、C、B、D、E五种元素,B原子得到一个电子后3P轨道全充满,则B原子电子排布式应为1S22S22P63S23P5,则B为Cl元素;A+比B形成的简单离子少一个电子层,则A+核外有10个电子,故A为Na元素;C原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的,电子排布式应为1S22S22P63S23P3,应为P元素,不可能是氮元素,否则沸点不是最低;D和E是位于同一主族的短周期元素,E元素的最高化合价与最低化合价的代数和为零,则E最外层电子数为4,E在其最高价氧化物中的质量分数为46.67%,令E的相对分子质量为x,则$\frac{x}{x+32}$=46.67%,解得x=28,故E为硅元素,则D为碳元素.
解答 解:有A、B、C、B、D、E五种元素,B原子得到一个电子后3P轨道全充满,则B原子电子排布式应为1S22S22P63S23P5,则B为Cl元素;A+比B形成的简单离子少一个电子层,则A+核外有10个电子,故A为Na元素;C原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的,电子排布式应为1S22S22P63S23P3,应为P元素,不可能是氮元素,否则沸点不是最低;D和E是位于同一主族的短周期元素,E元素的最高化合价与最低化合价的代数和为零,则E最外层电子数为4,E在其最高价氧化物中的质量分数为46.67%,令E的相对分子质量为x,则$\frac{x}{x+32}$=46.67%,解得x=28,故E为硅元素,则D为碳元素.
(1)B为氯元素,C为P元素,元素X与C、B均相邻,则X为硫元素,磷元素原子3p能级含有3个电子,为半满稳定状态,第一电离能大于相邻元素第一电离能,所以C、X元素的第一电离能Il(P)>I1(S),
故答案为:>;
(2)C为P元素,氢化物分子为PH3,中心原子P的价层电子对数为3+$\frac{5-1×3}{2}$=4,其杂化方式为 sp3,
故答案为:sp3;
(3)D为碳元素,D的最高氧化物是二氧化碳,为直线型对称结构,分子中正负电荷重心重合,是非极性分子,
故答案为:非极性;
(4)镧镍合金、铜钙合金及铈钴合金都具有相同类型的晶胞结构XY,它们有很强的储氢能力,其中镧镍合金的晶胞结构如图
①Ni2+的核外电子排布式为:1s22s22p63s23p63d8,故答案为:1s22s22p63s23p63d8;
②由图可知,晶胞中La原子数目为2×$\frac{1}{2}$+12×$\frac{1}{6}$=3,Ni原子数目为6+18×$\frac{1}{2}$=15,储氢后形成LaNinH4.5的合金(氢进入晶胞空隙,体积不变),故1:n=3:15,则n=5,晶胞中H原子数目为4.5×3=13.5,晶胞体积为9.0×10-23cm3,氢在合金中的密度为$\frac{13.5}{6.02×1{0}^{23}}$g÷9.0×10-23cm3=0.25g•cm-3,
故答案为:5;0.25.
点评 本题是对物质结构的考查,涉及电离能、分子性质、杂化轨道、核外电子排布、晶胞计算,(4)中注意顶点原子为12个晶胞共用,利用均摊法计算解答,难度中等.

 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )| A. | Z的氧化物对应的水化物一定是一种强酸 | |
| B. | 原子半径大小顺序是X>Y>Z | |
| C. | Y的单质比Z的单质更易与氢气反应 | |
| D. | Z的单质与Fe反应形成的化合物中,铁元素显+3价 |
| A. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| B. | 制饭勺、饭盒、高压锅等的不锈钢是合金 | |
| C. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
| A. | 氢氧化物碱性强弱:W(OH)2>ZOH | |
| B. | 原子序数:W>Z>X>Y | |
| C. | Y的气态氢化物比X的气态氢化物稳定 | |
| D. | 离子半径:r(W2+)>r(X-)>r(Y2-)>r(Z+) |
| A. | 断开化学键的过程会放出能量 | |
| B. | 氧化反应均为吸热反应 | |
| C. | 加热才能发生的反应一定是吸热反应 | |
| D. | 放热反应中,反应物的总能量大于生成物的总能量 |

 有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题:
有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题: ,YQ3中心原子的杂化类型为sp2杂化,除X外,其余元素的第一电离能由小到大顺序为B<C<O<N<F(元素符号回答).
,YQ3中心原子的杂化类型为sp2杂化,除X外,其余元素的第一电离能由小到大顺序为B<C<O<N<F(元素符号回答). ,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.
,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.

 ;该微粒的表示符号为O2-.
;该微粒的表示符号为O2-.