题目内容
1.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 78 g苯含有C=C键的数目为3 NA | |
| C. | 常温常压下,14 g由N2和CO组成的混合气体含有的电子总数为7 NA | |
| D. | 1 mol FeI2与足量氯气反应时转移的电子数为2 NA |
分析 A、ClO-是弱酸根,在溶液中会水解;
B、苯中不含碳碳双键;
C、N2和CO的摩尔质量均为28g/mol,且1molN2和CO中均含14mol电子;
D、亚铁离子和碘离子都能够被氯气氧化,1mol碘化亚铁完全反应消耗1.5mol氯气.
解答 解:A、ClO-是弱酸根,在溶液中会水解,故个数小于NA个,故A错误;
B、苯中不含碳碳双键,故B错误;
C、N2和CO的摩尔质量均为28g/mol,且1molN2和CO中均含14mol电子,故14gN2和CO混合气体的物质的量为0.5mol,含有7mol电子,故C正确;
D、1molFeI2中含有1mol亚铁离子、2mol碘离子,完全反应需要消耗1.5mol氯气,转移了3mol电子,转移的电子数为3NA,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
11.下列图示与对应的叙述相符的是 ( )
| A. |  表示某吸热反应分别在有、无催化剂的情兄下反应过程中的能量变化 | |
| B. | 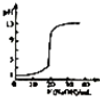 表示常温下,0.1 OOOmoi/LNaOH 溶液液滴定 20.00mL、0.0100/LHCl 溶液 所得到的滴定曲线 | |
| C. | 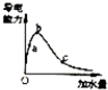 表示一定质量的冰醋酸加水稀释过程中,醋酸溶液电离程度:c>a>b | |
| D. | 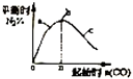 表示反应4CO+2NO2(g)?N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体识分数变化情况,由图可知NO2的转化率 c>b>a |
10.短周期四种元素离子W2+、X-、Y2-、Z+的电子层结构相同.下列说法正确的是( )
| A. | 氢氧化物碱性强弱:W(OH)2>ZOH | |
| B. | 原子序数:W>Z>X>Y | |
| C. | Y的气态氢化物比X的气态氢化物稳定 | |
| D. | 离子半径:r(W2+)>r(X-)>r(Y2-)>r(Z+) |
11.某溶液中可能含有SO42-、CO32-等.为了检验其中是否含有SO42-,除BaCl2溶液外,还需要的溶液是( )
| A. | H2SO4溶液 | B. | HCl溶液 | C. | NaOH溶液 | D. | NaNO3溶液 |


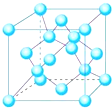 有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题:
有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题: ,YQ3中心原子的杂化类型为sp2杂化,除X外,其余元素的第一电离能由小到大顺序为B<C<O<N<F(元素符号回答).
,YQ3中心原子的杂化类型为sp2杂化,除X外,其余元素的第一电离能由小到大顺序为B<C<O<N<F(元素符号回答). ,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.
,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.