题目内容
2.下列叙述中正确的是( )| A. | CuSO4溶液、稀豆浆、硅酸都能产生丁达尔效应 | |
| B. | 将NaAlO2溶液蒸干后灼烧,所得固体产物为Al2O3 | |
| C. | 标准状况下,22.4L二氯甲烷中含σ键的数目为2.408×1024 | |
| D. | 室温下,7.0g乙烯和丁烯的混合气体中含有氢原子的数目为6.02×1023 |
分析 A.胶体有丁达尔效应,溶液无丁达尔效应;
B.NaAlO2溶液加入水解生成Al(OH)3与NaOH,最终又反应生成NaAlO2;
C.标准状况下二氯甲烷的状态为液体;
D.质量换算物质的量,乙烯和丁烯最简式相同,只需要计算7.0gCH2中所含氢原子数即可.
解答 解:A.丁达尔效应的是胶体特有的性质,稀豆浆、硅酸是胶体能产生丁达尔效应,而CuSO4溶液不能,故A错误;
B.NaAlO2溶液加入水解生成Al(OH)3与NaOH,最终又反应生成NaAlO2,NaAlO2溶液蒸发并灼烧得到NaAlO2,故B错误;
C.在标况下,二氯甲烷不是气体,题中条件无法计算22.4L二氯甲烷的物质的量,故C错误;
D.7.0g乙烯和丁烯的混合气体中含有的氢原子数目,可以计算7gCH2中含有氢原子数=$\frac{7g}{14g/mol}$×2=1mol,氢原子的数目为6.02×1023,故D正确.
故选D.
点评 本题考查胶体、盐类水解的应用、阿伏加德罗常数的有关计算和判断,题目难度不大,注意把握水解的原理及应用.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
12.设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A. | 足量铁在氯气中反应,1mol铁失去的电子数为2NA | |
| B. | 标准状况下22.4LH2中含中子数为2NA | |
| C. | NaBH4是一种重要的储氢载体,1molNaBH4与水反应[NaBH4+2H2O=NaBO2+4H2↑]时转移的电子数目为8NA | |
| D. | 常温下,1L0.2mol/L的盐酸溶液通人氨气当溶液pH=7,则溶液中NH4+数为0.2NA |
13.下列做法中,不利于保护水资源的是( )
| A. | 使用节水型马桶 | B. | 生活污水任意排放 | ||
| C. | 合理使用农药和化肥 | D. | 工业废水处理达标后排放 |
10.下列指定反应的离子方程式正确的是( )
| A. | 向NaOH溶液中通入过量CO2:2OH-+CO2=CO32-+H2O | |
| B. | 电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 向H2O2溶液中加入MnO2:2H2O2+4H++MnO2=O2↑+Mn2++4H2O | |
| D. | 向KAl(SO4)2溶液中滴加Ba(OH)2溶液至SO42-沉淀完全:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
17.氨氮废水中的氮元素多以NH4+和NH3•H2O的形式存在,在一定条件下,NH4+经过两步反应被氧化成NO3-,两步反应的能量变化示意图如图所示:
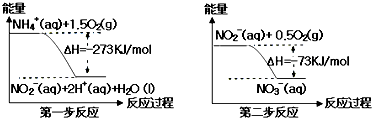
下列说法合理的是( )

下列说法合理的是( )
| A. | 该反应的催化剂是NO2- | |
| B. | 升高温度,两步反应速率均加快,有利于NH4+ 转化成NO3- | |
| C. | 在第一步反应中,当溶液中水的电离程度不变时,该反应即达平衡状态 | |
| D. | 1 mol NH4+在第一步反应中与1 mol NO2-在第二步反应中失电子数之比为1:3 |
7.下列有关物质分类的说法中,正确的是( )
| A. | 海水、氯水、氨水均为混合物 | |
| B. | SiO2不能和水反应,所以它不是酸性氧化物 | |
| C. | 液氨、液态氯化氢都是非电解质 | |
| D. | 冰、干冰、冰醋酸都是电解质 |
14.现有短周期元素X、Y、Z、M,周期表中元素X的原子半径最小,Y原子最外层电子数是次外层的3倍,Z的化合物焰色反应为黄色,Y和M同主族.下列说法不正确的是( )
| A. | 气态氢化物的稳定性:Y<M | |
| B. | 简单离子半径由大到小的顺序是:M>Y>Z | |
| C. | 化合物Z2Y2 中含有离子键和非极性共价键 | |
| D. | 等浓度的X2M与Z2M的溶液中,水的电离程度:X2M<Z2M |
11.如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列分析正确的是( )
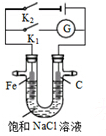

| A. | K1闭合,石墨棒上发生的反应为2H++2e→H2↑ | |
| B. | K2闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法 | |
| C. | K2闭合,石墨棒周围溶液pH逐渐升高 | |
| D. | K1闭合,电路中通过0.004NA个电子时,石墨棒上产生0.001mol气体 |


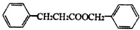 ;有机物M中含氧官能团名称是醛基.
;有机物M中含氧官能团名称是醛基.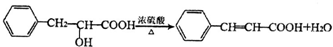 ,F→G
,F→G .
.