题目内容
7.工业上用闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)为原料生产ZnSO4•7H2O的工艺流程如下:(已知Cd的金属活动性介于Zn和Fe之间)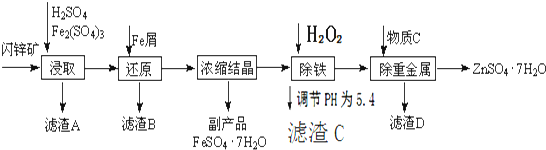
(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为S.
(2)浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为Fe2(SO4)3+ZnS=ZnSO4+2FeSO4+S.
(3)除铁过程加H2O2的目的是将Fe2+氧化为Fe3+便于形成沉淀而除去.
(4)置换法除去重金属离子Cd2+,所用物质C为Zn.
(5)取28.70g ZnSO4•7H2O加热至不同温度,剩余固体的质量变化如图所示.
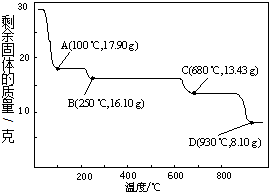
680℃时所得固体的化学式为b.
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4•H2O.
分析 闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)中加硫酸和Fe2(SO4)3,硫酸铁具有氧化性和硫化锌发生氧化还原反应生成淡黄色非金属单质硫,CdS、Fe2O3溶于硫酸形成离子,过滤,得到的滤渣为S,滤液中加Fe,三价铁离子被还原为亚铁离子,浓缩结晶得到FeSO4•7H2O,再通空气除去剩余的Fe,再加人还原剂把Cd2+还原为单质,过滤,蒸发浓缩滤液得到ZnSO4•7H2O,
(1)硫酸铁具有氧化性和硫化锌发生氧化还原反应生成淡黄色非金属单质硫;
(2)加入硫酸铁和硫酸是为了溶解氧化铁、硫化锌、硫化镉获得生产硫酸锌晶体和硫酸亚铁晶体的原料;其中硫酸铁氧化硫化锌;
(3)除铁是利用双氧水将亚铁离子氧化成铁离子,再调节pH值使铁离子沉淀完全;
(4)依据置换反应的反应条件是活泼金属进行置换,结合制备实验方案是制取ZnSO4•7H2O,依据除杂不能引入新的杂质,Cd的金属活动性介于Zn和Fe之间分析;
(5)28.70 g ZnSO4•7H2O的物质的量为0.1mol,分别分析生成ZnO、ZnSO4、ZnSO4•H2O的质量,进而确定温度.
解答 解:闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)中加硫酸和Fe2(SO4)3,硫酸铁具有氧化性和硫化锌发生氧化还原反应生成淡黄色非金属单质硫,CdS、Fe2O3溶于硫酸形成离子,过滤,得到的滤渣为S,滤液中加Fe,三价铁离子被还原为亚铁离子,浓缩结晶得到FeSO4•7H2O,再通空气除去剩余的Fe,再加人还原剂把Cd2+还原为单质,过滤,蒸发浓缩滤液得到ZnSO4•7H2O,
(1)依据流程转化关系分析判断,加入的硫酸铁具有氧化性能溶解氧化硫化锌、硫化镉,从滤渣A中可获得一种淡黄色非金属单质的副产品为氧化产物为硫,
故答案为:S;
(2)依据流程反应和生成硫单质可知,硫酸铁具有氧化性能氧化硫化锌和硫化镉,生成单质硫,反应的化学方程式为:Fe2(SO4)3+ZnS=ZnSO4+2FeSO4+S,
故答案为:Fe2(SO4)3+ZnS=ZnSO4+2FeSO4+S;
(3)除铁是利用双氧水将亚铁离子氧化成铁离子,再调节pH值使铁离子沉淀完全,所以除铁过程加H2O2的目的是将Fe2+氧化为Fe3+便于形成沉淀而除去,
故答案为:将Fe2+氧化为Fe3+便于形成沉淀而除去;
(4)制备实验方案是制取ZnSO4•7H2O,依据除杂不能引入新的杂质,Cd的金属活动性介于Zn和Fe之间,所以加入锌可以置换镉,
故答案为:Zn;
(5)28.70 g ZnSO4•7H2O的物质的量为0.1mol,若得ZnSO4•H2O的质量为17.90g,则温度为100℃;若得ZnSO4的质量为16.10g,则温度为250℃;若得ZnO的质量为8.10g,则温度为930℃;据此通过排除法确定680℃时所得固体的化学式为Zn3O(SO4)2;
故答案为:b.
点评 本题综合考查物质的制备、分离、提纯等知识,侧重于学生的分析能力、实验能力和计算能力的考查,把握物质性质是解题关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 丙烯与丁烯 | B. | 丙烷与丁炔 | C. | 乙烯与乙炔 | D. | 乙烷与丙烯 |
| A. | 苏打与稀盐酸反应:HCO3-+H+═CO2↑+H2O | |
| B. | Fe2O3与HI:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2 溶液至SO42-刚好完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+NH3•H2O+Al(OH)3↓ | |
| D. | 向NaClO溶液中通入少量SO2:SO2+ClO-+H2O═SO42-+Cl-+2H+ |
| A. | 充入N2使压强增大可加快反应速率 | B. | A的平均反应速率为:0.4mol/(L•min) | ||
| C. | 平衡状态时B、C的反应速率相等 | D. | C的平均反应速率为:0.2mol/(L•min) |
| A. | 14g聚乙烯中所含原子数为3NA | |
| B. | 48g 甲硫醇(CH4S)中含有C-H键数目为4NA | |
| C. | 标准状况下,11.2 L氯仿所含分子数为0.5 NA | |
| D. | 0.1mol苯乙烯中含有双键的数目为0.4NA |
| A. | 0.4mol/L | B. | 0.2mol/L | C. | 0.1mol/L | D. | 0.08mol/L |
过程Ⅰ:
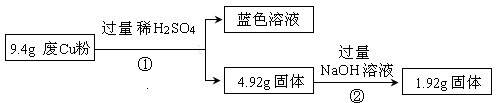
(1)废Cu粉中一定含有的杂质是Fe2O3、SiO2(填化学式)
(2)写出过程②发生反应的离子方程式:SiO2+2OH-═SiO32-+H2O.
过程Ⅱ:
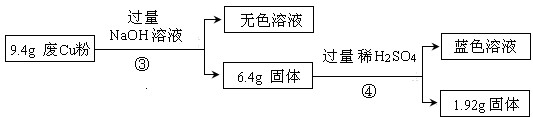
(3)综合过程Ⅰ、II,计算废Cu粉中各成分的质量之比是m(Fe2O3):m(Cu):m(SiO2)=16:16:15(化为最简整数比)
过程Ⅲ:已知25℃时:
| 电解质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶度积(Ksp) | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
| 开始沉淀时的pH | 5.4 | 6.5 | 3.5 |
| 完全沉淀时的pH | 6.4 | 9.6 | 4.0 |
(5)下列与Ⅲ方案 相关的叙述中,正确的是ACD填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH选择的试剂可以是氢氧化铜或氧化铜
D.在pH>4的溶液中Fe3+一定不能大量存在.