题目内容
19.将400mL0.3mol/L的FeSO4溶液加入到100mL K2Cr2O7熔液中,恰好使溶液中Fe2+全部转化为Fe3+,Cr2O72-被还原为Cr3+,则K2Cr2O7溶液的物质的量浓度为( )| A. | 0.4mol/L | B. | 0.2mol/L | C. | 0.1mol/L | D. | 0.08mol/L |
分析 设K2Cr2O7溶液的物质的量浓度为cmol/L,根据n=cV计算Fe2+、Cr2O72-物质的量,再根据电子转移守恒解答.
解答 解:设K2Cr2O7溶液的物质的量浓度为cmol/L,根据电子转移守恒,则:
0.4L×0.3mol/L×(3-2)=0.1L×cmol/L×2×(6-3)
解得c=0.2,
故选:B.
点评 本题考查氧化还原反应计算,关键是对电子转移守恒的理解,难度不大.

练习册系列答案
相关题目
14.下列各组物质之间的化学反应,反应产物一定为纯净物的是( )
| A. | CH2=CH2+Br2(CCl4)→ | B. | CH2=CH-CH2-CH3+HCl$→_{△}^{催化剂}$ | ||
| C. | C(CH3)4+Cl2$\stackrel{光照}{→}$ | D. | n CH3-CH=CH2$→_{△}^{催化剂}$ |
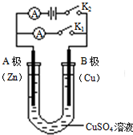 如右图所示,请按要求回答下列问题.
如右图所示,请按要求回答下列问题.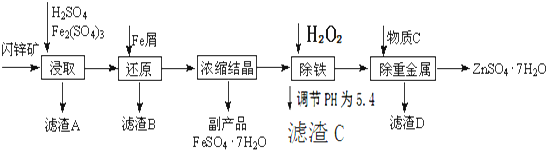

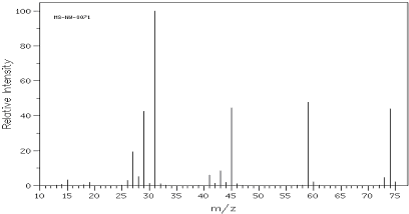

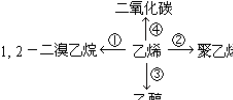
 ③CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH④CH2=CH2+3O2$\stackrel{点燃}{→}$2CO2+2H2O.
③CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH④CH2=CH2+3O2$\stackrel{点燃}{→}$2CO2+2H2O.
