题目内容
15.下列离子方程式正确的是( )| A. | 苏打与稀盐酸反应:HCO3-+H+═CO2↑+H2O | |
| B. | Fe2O3与HI:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2 溶液至SO42-刚好完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+NH3•H2O+Al(OH)3↓ | |
| D. | 向NaClO溶液中通入少量SO2:SO2+ClO-+H2O═SO42-+Cl-+2H+ |
分析 A、苏打成分是碳酸钠,可以和盐酸之间反应生成氯化钠、水以及二氧化碳;
B、铁离子具有氧化性,可以和还原性的碘离子之间发生反应生成亚铁离子和碘单质;
C、向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀,说明SO42-与Ba2+的比例是1:2;
D、二氧化硫溶于水得到亚硫酸,亚硫酸可以被次氯酸根离子氧化为硫酸,本身被还原为氯离子.
解答 解:A、苏打成分是碳酸钠,可以和盐酸之间反应生成氯化钠、水以及二氧化碳,反应为:CO32-+2H+═CO2↑+H2O,故A错误;
B、Fe2O3与HI反应是氢离子现将氧化物溶解,然后是得到的铁离子和还原性的碘离子之间发生反应,生成亚铁离子和碘单质,故B错误;
C、向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀,离子方程式为:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓,故C正确;
D、次氯酸钠具有强氧化性,能氧化二氧化硫生成硫酸根离子,自身被还原生成氯离子,离子方程式为ClO-+SO2+H2O=Cl-+SO42-+2H+,故D正确.
故选CD.
点评 本题考查了离子方程式的正误判断,该题是高考中的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等,注意苯酚钠和二氧化碳反应时,无论二氧化碳是否变化都生成碳酸氢钠,为易错点.

练习册系列答案
相关题目
5.下列各组物质中全部是弱电解质的是( )
| A. | NH3、Cl2、H3PO4 | B. | AgCl、Ba(OH)2、H2S | ||
| C. | H2SO3、NaOH、H2SO4 | D. | NH3•H2O、H2O、CH3COOH |
3.下列解释实验事实的方程式一定正确的是( )
| A. | 等物质的量MgCl2、Ba(OH)2和HCl溶液混合:Mg2++3OH-+H+═Mg(OH)2↓+H2O | |
| B. | 由水电离出来的C(OH-)=10-13mol/L的溶液中加入铝粉:2Al+6H+═3H2↑+2Al3+ | |
| C. | 硝酸铁溶液中滴加足量HI溶液:Fe3++3NO3-+12H++10I-═Fe2++5I2↓+3NO↑+6H2O | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
20.有一块镁铝合金,其中镁与铝的质量比是8:9.加入足量稀HNO3使其完全溶解后,产生NO气体在标准状况下的体积为11.2L,溶液中再加入NaOH溶液,生成沉淀质量的最大值为( )
| A. | 17.4g | B. | 46.8g | C. | 40.8g | D. | 23.4g |

 ,CH3CH═CH2$→_{500℃}^{Cl_{2}}$
,CH3CH═CH2$→_{500℃}^{Cl_{2}}$ .以异戊二烯(
.以异戊二烯( 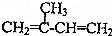 ),丙烯为原料合成
),丙烯为原料合成 .(用反应流程图表示,并注明反应条件)
.(用反应流程图表示,并注明反应条件)