题目内容
1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体N2O4的混合气体1120mL(标准状况)。向反应后的溶液中加入1.0 mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
| A.该合金中铜与镁的物质的量之比是2:l |
| B.该浓硝酸中HN03的物质的量浓度是14.0 mol/L |
| C.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL |
| D.NO2和N2O4的混合气体中,NO2的体积分数是80% |
C
解析试题分析:A选项不正确;B选项正确,C选项正确;,D选项不正确。解:A、金属离子全部沉淀时,得到2.54g沉淀为氢氧化铜、氢氧化镁,故沉淀中氢氧根的质量为2.54g-1.52g=1.02g,氢氧根的物质的量为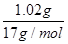 =0.06mol,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根的物质的量,令铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则:
=0.06mol,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根的物质的量,令铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则: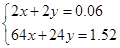 ,解得x=0.02,y=0.01,故合金中铜与镁的物质的量之比是0.02mol:0.01mol=2:1,故A正确;B、该浓硝酸密度为1.40g·mL-1、质量分数为63%,故该浓硝酸的物质的量浓度为
,解得x=0.02,y=0.01,故合金中铜与镁的物质的量之比是0.02mol:0.01mol=2:1,故A正确;B、该浓硝酸密度为1.40g·mL-1、质量分数为63%,故该浓硝酸的物质的量浓度为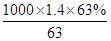 mol·L-1=14mol·L-1,故B正确;C、根据钠离子守恒可知,氢氧化钠的物质的量等于反应后溶液中硝酸钠的物质的量,根据氮元素守恒可知,硝酸钠的物质的量为0.05L×14mol·L-1-0.04mol-(0.05-0.04)×2=0.64mol,故需要氢氧化钠溶液的体积为
mol·L-1=14mol·L-1,故B正确;C、根据钠离子守恒可知,氢氧化钠的物质的量等于反应后溶液中硝酸钠的物质的量,根据氮元素守恒可知,硝酸钠的物质的量为0.05L×14mol·L-1-0.04mol-(0.05-0.04)×2=0.64mol,故需要氢氧化钠溶液的体积为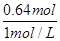 =0.64L=640mL,故C正确;D、NO2和N2O4混合气体的物质的量为
=0.64L=640mL,故C正确;D、NO2和N2O4混合气体的物质的量为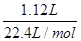 =0.05mol,令二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.05-a)mol,根据电子转移守恒可知,a×1+(0.05-a)×2×1=0.06,解得a=0.04,故NO2的体积分数是
=0.05mol,令二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.05-a)mol,根据电子转移守恒可知,a×1+(0.05-a)×2×1=0.06,解得a=0.04,故NO2的体积分数是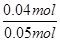 ×100%=80%,故D错误;故选D.
×100%=80%,故D错误;故选D.
考点:考查混合物的有关计算。

在汽车尾气处理装置中常发生如下反应:4CO+2NO2=4CO2+N2。下列对该反应的说法中正确的是
| A.该反应属于置换反应 |
| B.该反应中氧化剂是CO,还原剂是NO2 |
| C.该反应生成14 g N2时,转移8 mol e- |
| D.该反应能减少汽车尾气对环境的污染 |
氧化还原反应在生产、生活中具有广泛的用途。下列生产、生活中的事例不包含氧化还原反应的是
| A.金属锈蚀 | B.海水晒盐 | C.食物腐败 | D.燃放鞭炮 |
下列说法正确的是
A.一定条件反应:2CO(g)  CO2(g)+C(s)可自发进行,则该反应的△H>0 CO2(g)+C(s)可自发进行,则该反应的△H>0 |
| B.向硫酸亚铁溶液中滴加硫氰化钾溶液产生血红色沉淀说明溶液已变质 |
| C.在反应KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,当生成1.5mol Cl2时,反应中转移的电子数为2.5NA |
| D.相同物质的量浓度的下列溶液:①NH4HSO4②NH4Cl③NH3·H2O,水电离程度由大到小的顺序是:①>②>③ |
关于反应Zn+ 2HNO3+ NH4NO3→ N2↑+ 3H2O+ Zn(NO3)2,下列判断正确的是
| A.生成1 mol N2,电子转移总数为3NA | B.生成1 mol N2,电子转移总数为5NA |
| C.溶解1 mol Zn,电子转移总数为2NA | D.溶解1 mol Zn,电子转移总数为4NA |
在5.6 g Fe粉中加入过量的稀硫酸溶液,待反应完全后,再加入1mol·L-1 KNO3溶液25mL,恰好反应完全。该反应的方程式为:
FeSO4 +KNO3 +H2SO4→K2SO4 +Fe2(SO4)3+NxOy + H2O(未配平),则对该反应的下列说法正确的是
| A.化学方程式中按物质顺序的计量数是:8、2、5、1、4、1、5 |
| B.反应中氧化产物是N2O |
| C.反应过程中转移的电子数为8mol电子 |
| D.氧化产物和还原产物的物质的量之比为4∶1 |
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O则该反应中化合价发生变化和未发生变化的N原子数之比为
| A.1:4 | B.1:2 | C.2:1 | D.4:1 |
著名化学家徐光宪获得国家最高科学技术奖,以表彰他在稀土萃取理论方面作出的贡献。已知:金属铈(稀土元素)在空气中易氧化变暗,受热时燃烧,遇水很快反应。(注:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+>I2。)下列说法正确的是
A.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI  CeI4 + 2H2↑ CeI4 + 2H2↑ |
| B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + 2Fe2+=Ce3+ + 2Fe3+ |
| C.在一定条件下,电解熔融状态的CeO2制Ce,在阴极获得铈 |
D.铈的四种核素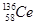 、 、 、 、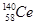 、 、 ,它们互称为同素异形体 ,它们互称为同素异形体 |
关于反应3Cl2 + 6KOH 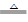 KClO3 + 5KCl + 3H2O,以下说法正确的是
KClO3 + 5KCl + 3H2O,以下说法正确的是
| A.KOH既不是氧化剂,又不是还原剂 |
| B.Cl2是氧化剂,KOH是还原剂 |
| C.3mol氯气参加反应转移6 mol电子 |
| D.被氧化的氯元素的质量为被还原的氯元素质量的5倍 |