题目内容
关于反应Zn+ 2HNO3+ NH4NO3→ N2↑+ 3H2O+ Zn(NO3)2,下列判断正确的是
| A.生成1 mol N2,电子转移总数为3NA | B.生成1 mol N2,电子转移总数为5NA |
| C.溶解1 mol Zn,电子转移总数为2NA | D.溶解1 mol Zn,电子转移总数为4NA |
B
解析试题分析:A.生成1 mol N2,电子转移总数应该为5NA,A错误, B正确。C.溶解1 mol Zn,电子转移总数为5NA,CD错误。
考点:本题考查氧化还原的概念及电子的计算。

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科学家发现,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒,这是因为对人体无害的+5价砷类物质在维生素C的作用下,能够转化为有毒的+3价砷类化合物。下列说法中不正确的是
| A.维生素C具有还原性 |
| B.上述过程中砷元素发生还原反应 |
| C.上述过程中+5价砷类物质作氧化剂 |
| D.1 mol+5价砷完全转化为+3价砷,共失去2 mol电子 |
下列反应中必须加入还原剂才能进行的是
| A.Cl2→Cl- | B.Zn→ Zn2+ | C.H2→H2O | D.CuO→CuCl2 |
Cl2是纺织工业中常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”。S2O32-和Cl2反应的产物之一为SO42-。下列说法中,不正确的是
| A.该反应中氧化剂是Cl2 |
| B.根据该反应可判断还原性:S2O32- > Cl- |
| C.上述反应中,每生成l mol SO42-,转移4 mol电子 |
| D.SO2与氯气的漂白原理相同,所以也可以用SO2做纺织工业的漂白剂 |
对于反应3Br2+6NaOH=5NaBr+NaBrO3+3H2O,以下叙述正确的是
| A.Br2是氧化剂,NaOH是还原剂 |
| B.氧化产物与还原产物的物质的量的比为5∶1 |
| C.Br2既是氧化剂又是还原剂 |
| D.每生成1mol的NaBrO3转移6mol的电子 |
1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体N2O4的混合气体1120mL(标准状况)。向反应后的溶液中加入1.0 mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
| A.该合金中铜与镁的物质的量之比是2:l |
| B.该浓硝酸中HN03的物质的量浓度是14.0 mol/L |
| C.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL |
| D.NO2和N2O4的混合气体中,NO2的体积分数是80% |
工业上常利用反应 3Cl2 + 6KOH(热) → KClO3 + 5KCl + 3H2O 制取KClO3(混有KClO)。实
验室模拟上述制备:在含溶质14mol的KOH(aq,热)中通入一定量Cl2,充分反应后,测得
溶液中n(Cl-)=11mol;将此溶液低温蒸干,得到的固体中KClO3的物质的量可能为
| A.2.20 | B.2.33 | C.2.00 | D.0.50 |
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体a mol,向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO固体120g,若上述气体为NO,则a可能为 mol.
| A.2.50 | B.4.00 | C.7.50 | D.3.15 |
对反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4的下列说法正确的是
| A.该反应的氧化剂只有CuSO4 |
| B.SO42-既不是氧化产物也不是还原产物 |
C.1 mol CuSO4还原了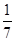 mol的S mol的S |
| D.被还原的S和被氧化的S的质量比为7:3 |