题目内容
19.下列说法正确的是(NA为阿伏加德罗常数的值)( )| A. | 常温、常压下,11.2 L N2含有的分子数为0.5NA | |
| B. | 常温常压下,1mol氦气含有的原子数为NA | |
| C. | 71gCl2所含原子数为2NA | |
| D. | 在同温同压下,相同体积的任何气体单质所含分子数和原子数都相等 |
分析 A.氮气所处状态不是标准状况;
B.稀有气体为单原子分子,1mol氦气含有1mol原子;
C.71g Cl2的物质的量为1mol,含有2mol氯原子;
D.气体单质分为单原子分子、双原子分子和多元子分子.
解答 解:A.氮气所处状态不是标准状况,不能使用气体摩尔体积22.4L/mol,故A错误;
B.氦气为单原子分子,常温常压下,1mol氦气含有的原子数为NA,故B正确;
C.71g Cl2所含原子的物质的量为2mol,含有的原子数为2NA,故C正确;
D.气体单质分为单原子分子、双原子分子和多元子分子,在同温同压下,任何体积的气体的分子数相同,但原子数不一定相同,故D错误;
故选:BC.
点评 本题考查阿伏加德罗常数的有关计算和判断,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件,题目难度不大.

练习册系列答案
相关题目
20.有关氧化还原反应实质的说法中正确的是( )
| A. | 是否有原子的重新组合 | B. | 是否有元素的化合价的变化 | ||
| C. | 是否有氧元素的参加 | D. | 是否有元素原子的电子转移 |
1.恒温下,将NO2装入带活塞的密闭容器中,当反应2NO2(g)?N2O4(g)达到平衡后,慢慢压缩气体体积,使体积减小一半,下列叙述正确的是( )
| A. | 压强为原来的两倍 | B. | 平衡向右移动,混合气体颜色变浅 | ||
| C. | 压强增大,但小于原来的两倍 | D. | 平衡向右移动,混合气体密度增大 |
7.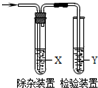 用下列方法制备乙烯并用如图所示装置检验乙烯时不需要除杂的是( )
用下列方法制备乙烯并用如图所示装置检验乙烯时不需要除杂的是( )
 用下列方法制备乙烯并用如图所示装置检验乙烯时不需要除杂的是( )
用下列方法制备乙烯并用如图所示装置检验乙烯时不需要除杂的是( )| 乙烯的制备 | 试剂X | 试剂Y | |
| A | CH3CH2Br与NaOH乙醇溶液共热 | 水 | Br2的CCl4溶液 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | 水 | KMnO4酸性溶液 |
| C | C2H5OH与浓H2SO4 | NaOH溶液 | KMnO4酸性溶液 |
| D | C2H5OH与浓H2SO4 | NaOH溶液 | Br2的CCl4溶液 |
| A. | A | B. | B | C. | C | D. | D |
4.化学与人类生活、工农业生产、科学技术等息息相关,下列说法正确的是( )
| A. | 在涂料中尽量用液态有机物代替水作溶剂以减少环境污染 | |
| B. | 世博会很多场馆的外壳使用非晶硅薄膜,以充分利用太阳能,体现低碳经济 | |
| C. | 石油分馏可获得乙烯、丙烯和丁二烯 | |
| D. | 绿色化学的核心是应用化学原理对环境污染进行治理 |
11.下列反应可能会生成Na2O2的是( )
| A. | 金属钠高温还原CO2,制人工金刚石膜或粉 | |
| B. | 汽车气囊中用氧化铁除去NaN3受撞击时分解生成的钠 | |
| C. | 隔绝空气条件下加热金属钠与NaNO2反应制取Na2O | |
| D. | 将4.6 g钠与1.6g硫粉迅速混合起来,并放在石棉网上加热 |
8.密闭容器中,反应2X(g)?Y(g)+Z(s)已达到平衡,下列叙述正确的是( )
| A. | 若升高温度,X(g)的浓度增大,则正反应为吸热反应 | |
| B. | 若容器体积不变,在平衡混合物中加入少量Z(s),则平衡向左移动 | |
| C. | 压强变化对该平衡没有影响 | |
| D. | 若容器体积不变,加入氦气平衡不移动 |
9.有关化学用语正确的是( )
| A. | 乙烯的实验式:C2H4 | B. | 乙炔的电子式: | ||
| C. | 甲酸甲酯的结构简式:C2H4O | D. | 氢氧根电子式: |