题目内容
11.下列各组中的两种固态物质熔化或升华时,克服的微粒间相互作用力属于同种类型的是( )| A. | 碘和氯化钾 | B. | 金刚石和冰晶石 | C. | 二氧化硅和干冰 | D. | 冰和冰醋酸 |
分析 首先判断晶体类型,离子晶体熔化克服离子键,原子晶体熔化克服共价键,金属晶体熔化克服金属键,分子晶体熔化或升华克服分子间作用力,以此来解答.
解答 解:A.碘属于分子晶体熔化克服分子间作用力,氯化钾属于离子晶体熔化克服离子键,类型不同,故A错误;
B.金刚石属于原子晶体熔化克服共价键,重晶石属于离子晶体熔化克服离子键,类型不同,故B错误;
C.二氧化硅属于原子晶体熔化克服共价键,干冰属于分子晶体熔化克服分子间作用力,类型不同,故C错误;
D.冰和冰醋酸都属于分子晶体,熔化均克服分子间作用力,类型相同,故D正确.
故选D.
点评 本题考查晶体类型及化学键,为高频考点,明确不同类型的晶体在熔化时克服不同的作用力是解答本题的关键,题目难度不大,注意把握晶体类型.

练习册系列答案
相关题目
17.下列关于物质性质变化的比较,正确的是( )
| A. | Na、Mg、Al还原性依次增强 | B. | HClO4、HIO4、HBrO4酸性依次减弱 | ||
| C. | KOH、NaOH、LiOH碱性依次减弱 | D. | S、Na、O原子半径依次减小 |
6.下列叙述中,正确的是( )
| A. | 可用带玻璃塞的玻璃瓶盛放NaOH溶液 | |
| B. | SiO2和CO2都是酸性氧化物,既能与水反应,又能与NaOH溶液反应 | |
| C. | SiO2与纯碱在高温条件下反应生成CO2,说明硅酸的酸性比碳酸强 | |
| D. | 石灰石是工业制备普通玻璃和普通水泥的共同原料 |
16.有八种物质:①甲烷、②苯、③聚乙烯、④乙烯、⑤2-丁炔、⑥环己烷、⑦邻二甲苯、⑧环己烯,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是( )
| A. | ②③④⑤⑧ | B. | ④⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |
3.化学与材料、生活和环境密切相关.下列有关说法中错误的是( )
| A. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| B. | 大量使用化肥和农药,以提高农作物产量 | |
| C. | 不随意丢弃旧电池,生活垃圾分类放置 | |
| D. | “绿色化学”的核心是使原料尽可能全部转化为目标产物 |
20.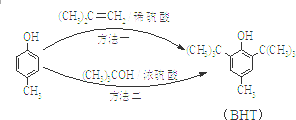 BHT是一种常用的食品抗氧化剂,从
BHT是一种常用的食品抗氧化剂,从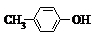 出发合成BHT的方法有如下两种.下列说法不正确的是( )
出发合成BHT的方法有如下两种.下列说法不正确的是( )
 BHT是一种常用的食品抗氧化剂,从
BHT是一种常用的食品抗氧化剂,从 出发合成BHT的方法有如下两种.下列说法不正确的是( )
出发合成BHT的方法有如下两种.下列说法不正确的是( )| A. | 推测BHT在水中的溶解度小于苯酚 | |
| B. | BHT与 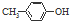 都能使酸性KMnO4褪色 都能使酸性KMnO4褪色 | |
| C. | 方法一和方法二的反应类型都是加成反应 | |
| D. | BHT与 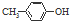 具有完全相同的官能团 具有完全相同的官能团 |
1.下列事实可证明NH3•H2O是弱碱的是( )
| A. | 氨水能与氯化镁反应生成MgCl2溶液反应 | |
| B. | 氨气易溶于水 | |
| C. | 0.1摩尔/升的NH4Cl的pH值约为5 | |
| D. | 氨水可以使得酚酞试液变红 |
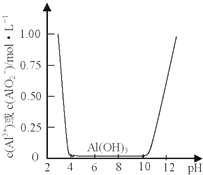 某课外小组的同学拟用废铝箔制取硫酸铝晶体,已知铝的物种类别与溶液pH关系如图所示,实验中可选用的试剂:处理过的铝箔;2.0mol•L-1NaOH溶液:2.0mol•L-1硫酸
某课外小组的同学拟用废铝箔制取硫酸铝晶体,已知铝的物种类别与溶液pH关系如图所示,实验中可选用的试剂:处理过的铝箔;2.0mol•L-1NaOH溶液:2.0mol•L-1硫酸