题目内容
12.现有①BaCl2 ②金刚石 ③金属铜 ④KOH ⑤干冰 ⑥纯硫酸 ⑦二氧化硅 ⑧白磷 ⑨K2O ⑩NH4Cl十种物质,按下列要求回答:(1)熔化时需要破坏共价键的是②⑦(填序号);属于分子晶体的是⑤⑥⑧(填序号);
(2)固体不导电,常压下熔化时能导电的是①④⑨(填序号).
(3)写出物质④的电子式
 ;物质⑤的结构式O=C=O.
;物质⑤的结构式O=C=O.
分析 根据物质含有的化学键类型判断晶体的类型和性质,
(1)熔化时需要破坏共价键的晶体为原子晶体;分子晶体由非金属性元素组成,熔沸点较低;
(2)固体不导电,常压下熔化时能导电的应为离子化合物;
(3)KOH为离子化合物,二氧化碳为直线形分子.
解答 解:(1)共价键由非金属性元素形成,原子之间存在共用电子对,题中金刚石、二氧化硅属于原子晶体,熔化时需要破坏共价键;分子晶体由非金属性元素组成,熔沸点较低,干冰、纯硫酸以及白磷属于分子晶体,故答案为:②⑦;⑤⑥⑧;
(2)固体不导电,常压下熔化时能导电的应为离子化合物,氯化钡、氢氧化钾以及氢氧化钾符合,氯化铵不稳定,融化时分解,故答案为:①④⑨;
(3)KOH为离子化合物,电子式为 ,干冰的成分是二氧化碳,是共价化合物,电子式为:
,干冰的成分是二氧化碳,是共价化合物,电子式为: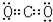 .结构式为O=C=O,
.结构式为O=C=O,
故答案为: ; O=C=O.
; O=C=O.
点评 本题考查的知识点较多,为高频考点,侧重考查学生对离子键、共价键,离子化合物、共价化合物及其电子式的书写的辨别能力.

练习册系列答案
相关题目
3.化学与材料、生活和环境密切相关.下列有关说法中错误的是( )
| A. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| B. | 大量使用化肥和农药,以提高农作物产量 | |
| C. | 不随意丢弃旧电池,生活垃圾分类放置 | |
| D. | “绿色化学”的核心是使原料尽可能全部转化为目标产物 |
20.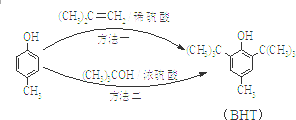 BHT是一种常用的食品抗氧化剂,从
BHT是一种常用的食品抗氧化剂,从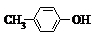 出发合成BHT的方法有如下两种.下列说法不正确的是( )
出发合成BHT的方法有如下两种.下列说法不正确的是( )
 BHT是一种常用的食品抗氧化剂,从
BHT是一种常用的食品抗氧化剂,从 出发合成BHT的方法有如下两种.下列说法不正确的是( )
出发合成BHT的方法有如下两种.下列说法不正确的是( )| A. | 推测BHT在水中的溶解度小于苯酚 | |
| B. | BHT与 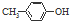 都能使酸性KMnO4褪色 都能使酸性KMnO4褪色 | |
| C. | 方法一和方法二的反应类型都是加成反应 | |
| D. | BHT与 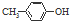 具有完全相同的官能团 具有完全相同的官能团 |
7.下列说法一定正确的是( )
| A. | CO2与CaO化合是放热反应,则CaCO3分解是吸热反应 | |
| B. | 需要加热方能发生的反应一定是吸热反应 | |
| C. | 若反应X+Y=M是放热反应,该反应一定不用加热 | |
| D. | 硫酸与氢氧化钠发生中和反应生成水是放热反应,则水的能量比硫酸的能量低 |
17.下列变化过程中,克服了分子间作用力的是( )
| A. | 食盐熔化 | B. | 氯化氢溶于水 | C. | 干冰气化 | D. | 金属钠熔化 |
4.X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期.X原子的最外层电子数是其电子层数的3倍.Z原子的核外电子数比Y原子少1.下列说法正确的是( )
| A. | 元素非金属性由强到弱的顺序是:X>Y>Z | |
| B. | Y元素最高价氧化物对应水化物的化学式可表示为H4YO4 | |
| C. | 3种元素的气态氢化物中,Z的气态氢化物最稳定 | |
| D. | 原子半径由大到小的顺序为 Z>Y>X |
1.下列事实可证明NH3•H2O是弱碱的是( )
| A. | 氨水能与氯化镁反应生成MgCl2溶液反应 | |
| B. | 氨气易溶于水 | |
| C. | 0.1摩尔/升的NH4Cl的pH值约为5 | |
| D. | 氨水可以使得酚酞试液变红 |
2.如图装置中能构成原电池产生电流的是( )
| A. | 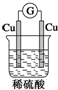 | B. | 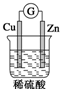 | C. | 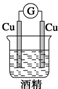 | D. | 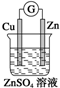 |
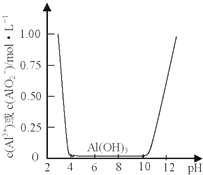 某课外小组的同学拟用废铝箔制取硫酸铝晶体,已知铝的物种类别与溶液pH关系如图所示,实验中可选用的试剂:处理过的铝箔;2.0mol•L-1NaOH溶液:2.0mol•L-1硫酸
某课外小组的同学拟用废铝箔制取硫酸铝晶体,已知铝的物种类别与溶液pH关系如图所示,实验中可选用的试剂:处理过的铝箔;2.0mol•L-1NaOH溶液:2.0mol•L-1硫酸