题目内容
16.铜~锌原电池如图所示,电解质溶液为稀硫酸,下列说法不正确的是( )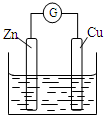
| A. | 铜电极上发生还原反应 | B. | 锌电极是原电池的负极 | ||
| C. | 电子从铜极经过外电路流向锌极 | D. | 锌电极上的反应为Zn-2e-═Zn2+ |
分析 该装置中,锌易失电子发生氧化反应而作负极,铜作正极,正极上氢离子得电子发生还原反应,电子经过导线从负极流向正极,据此解答即可.
解答 解:A、铜作正极,正极上氢离子得电子发生还原反应,故A正确;
B、该装置中,锌易失电子发生氧化反应而作负极,故B正确;
C、反应中电子经过导线由锌极流向Cu极,故C错误;
D、锌为原电池的负极,失去电子发生氧化反应,电极反应方程式为:Zn-2e-=Zn2+,故D正确,故选C.
点评 本题主要考查了原电池原理,明确正负极的判断、正负极上发生的电极反应即可解答,难度不大.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
6.下列叙述中,正确的是( )
| A. | 可用带玻璃塞的玻璃瓶盛放NaOH溶液 | |
| B. | SiO2和CO2都是酸性氧化物,既能与水反应,又能与NaOH溶液反应 | |
| C. | SiO2与纯碱在高温条件下反应生成CO2,说明硅酸的酸性比碳酸强 | |
| D. | 石灰石是工业制备普通玻璃和普通水泥的共同原料 |
7.下列说法一定正确的是( )
| A. | CO2与CaO化合是放热反应,则CaCO3分解是吸热反应 | |
| B. | 需要加热方能发生的反应一定是吸热反应 | |
| C. | 若反应X+Y=M是放热反应,该反应一定不用加热 | |
| D. | 硫酸与氢氧化钠发生中和反应生成水是放热反应,则水的能量比硫酸的能量低 |
4.X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期.X原子的最外层电子数是其电子层数的3倍.Z原子的核外电子数比Y原子少1.下列说法正确的是( )
| A. | 元素非金属性由强到弱的顺序是:X>Y>Z | |
| B. | Y元素最高价氧化物对应水化物的化学式可表示为H4YO4 | |
| C. | 3种元素的气态氢化物中,Z的气态氢化物最稳定 | |
| D. | 原子半径由大到小的顺序为 Z>Y>X |
11.对于反应A2+3B2═2C+D,化学反应速率最快的是( )
| A. | V(B2)=0.8mol/(L•s) | B. | V(D)=0.6mol/(L•s) | ||
| C. | V(C)=0.6mol/(L•s) | D. | V(A2)=0.8mol/(L•min) |
1.下列事实可证明NH3•H2O是弱碱的是( )
| A. | 氨水能与氯化镁反应生成MgCl2溶液反应 | |
| B. | 氨气易溶于水 | |
| C. | 0.1摩尔/升的NH4Cl的pH值约为5 | |
| D. | 氨水可以使得酚酞试液变红 |
8.对于任何一个平衡体系,采取下列措施一定会引起平衡移动的是( )
| A. | 加入一种反应物 | B. | 增加体系的压强 | C. | 升高温度 | D. | 使用催化剂 |
5.下列各组有机物中,无论以何种比例混合,只要二者物质的量之和不变,完全燃烧时消耗氧气的物质的量和生成水的物质的量分别相等的是( )
| A. | 乙烷和乙醇 | B. | 乙烯和环丙烷 | C. | 苯和苯甲酸 | D. | 甲醛和甲酸 |
6.用铂电极电解100mL HNO3与AgNO3 的混合液,通电一段时间后,两极均收集到2.24L 气体(标准状况下),则原混合液中c(Ag+)为( )
| A. | 1mol/L | B. | 2mol/L | C. | 2.5mol/L | D. | 3mol/L |