题目内容
10.下列说法中不正确的是( )| A. | 19世纪中叶,门捷列夫的突出贡献是发现元素周期律 | |
| B. | 在金属和非金属元素交界处最容易找到半导体材料 | |
| C. | 在过渡元素中容易找到各种优良的催化剂和耐高温、耐腐蚀的合金材料 | |
| D. | 根据硼在元素周期表中的位置,推测硼的最高价含氧酸的化学式可能是HBO3 |
分析 A、门捷列夫在19世纪中叶,发现了周期律;
B、根据金属元素与非金属元素的分界线附近的金属的导电性来回答;
C、制备催化剂及耐高温和耐腐蚀的元素在过渡元素区域;
D、硼位于元素周期表的第二周期第ЩA族,则最外层有3个电子,对应的最高价含氧酸中B元素的化合价为+3价,以此解答.
解答 解:A、1869年,俄国化学家门捷列夫发现了元素周期律,并编制出元素周期表,故A正确;
B、在金属元素与非金属元素的分界线附近的元素既有金属性又有非金属性,则可作半导体材料,故B正确;
C、制备催化剂及耐高温和耐腐蚀的元素在过渡元素区域,故C正确;
D、HBO3中硼的化合价为+5价,故D错误;
故选D.
点评 本题考查原子结构与元素的性质,题目难度不大,本题注意根据元素在周期表中的位置判断最高化合价,注意化合物中元素化合价的分析.

练习册系列答案
相关题目
20.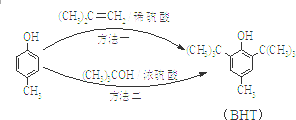 BHT是一种常用的食品抗氧化剂,从
BHT是一种常用的食品抗氧化剂,从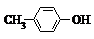 出发合成BHT的方法有如下两种.下列说法不正确的是( )
出发合成BHT的方法有如下两种.下列说法不正确的是( )
 BHT是一种常用的食品抗氧化剂,从
BHT是一种常用的食品抗氧化剂,从 出发合成BHT的方法有如下两种.下列说法不正确的是( )
出发合成BHT的方法有如下两种.下列说法不正确的是( )| A. | 推测BHT在水中的溶解度小于苯酚 | |
| B. | BHT与 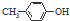 都能使酸性KMnO4褪色 都能使酸性KMnO4褪色 | |
| C. | 方法一和方法二的反应类型都是加成反应 | |
| D. | BHT与 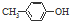 具有完全相同的官能团 具有完全相同的官能团 |
1.下列事实可证明NH3•H2O是弱碱的是( )
| A. | 氨水能与氯化镁反应生成MgCl2溶液反应 | |
| B. | 氨气易溶于水 | |
| C. | 0.1摩尔/升的NH4Cl的pH值约为5 | |
| D. | 氨水可以使得酚酞试液变红 |
18.下列叙述中,错误的是( )
| A. | 纯水在25℃和80℃时的氢离子浓度,前者小于后者 | |
| B. | 常温下,0.01mol/L的NaOH溶液中,由水电离出的c(H+)为10-2mol/L | |
| C. | pH=6的溶液不一定呈酸性,c(H+)>c(OH-)的溶液才是酸性溶液 | |
| D. | 温度升高,水的离子积常数会增大 |
5.下列各组有机物中,无论以何种比例混合,只要二者物质的量之和不变,完全燃烧时消耗氧气的物质的量和生成水的物质的量分别相等的是( )
| A. | 乙烷和乙醇 | B. | 乙烯和环丙烷 | C. | 苯和苯甲酸 | D. | 甲醛和甲酸 |
15.过量铁粉与100mL 0.01mol•L-1的稀盐酸反应.为了加快此反应速率而不改变H2的总量,可以使用如下方法中的( )
| A. | 加NaCl溶液 | B. | 加水 | ||
| C. | 升高温度(不考虑盐酸挥发) | D. | 滴入几滴浓盐酸 |
2.如图装置中能构成原电池产生电流的是( )
| A. | 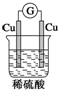 | B. | 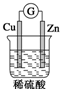 | C. | 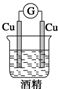 | D. | 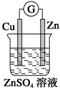 |
19.北京大学和中国科学院的化学工作者合作,已成功研制出碱金属与C60形成的球碳盐K3C60.实验测知该物质属于离子晶体,具有良好的超导性.下列关于K3C60的组成和结构分析不正确的是( )
| A. | K3C60中既有离子键又有非极性键 | |
| B. | 1mol K3C60中含有的离子数目为3NA | |
| C. | 该晶体在熔融状态下能导电 | |
| D. | 该物质的化学式不能写作KC20 |
20.以下有关原子结构及元素周期律的叙述正确的是( )
| A. | 第IA族元素铯的两种同位素137Cs比133Cs多4个质子 | |
| B. | P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 | |
| C. | 第VIIA族元素从上到下,其氢化物的稳定性逐渐增强 | |
| D. | 元素的最高正价数均等于该元素原子的最外层电子数 |