题目内容
9.氢气可以在氧气中燃烧.在该反应中:断裂1mol H-H键消耗的能量为Q1kJ,断裂1mol O=O键消耗的能量为Q2kJ,形成1mol H-O键释放的能量为Q3 kJ.下列关系式中,正确的是( )| A. | 2Q1+Q2>Q3 | B. | Q1+Q2>2Q3 | C. | 2Q1+Q2<4Q3 | D. | 2Q1+Q2<2Q3 |
分析 氢气在氧气中燃烧,该反应放热,△H<0,根据反应热△H=反应物的总键能-生成物的总键来计算该反应的反应热,据此解答.
解答 解:破坏1molH-H消耗的能量为Q1kJ,则H-H键能为Q1kJ/mol,
破坏1molO=O键消耗的能量为Q2kJ,则O=O键键能为Q2kJ/mol,
形成1molH-O键释放的能量为Q3kJ,则H-O键能为Q3kJ/mol,
对于2H2(g)+O2(g)═2H2O,反应热△H=反应物的总键能-生成物的总键能,故:
反应热△H=2Q1kJ/mol+Q2kJ/mol-4Q3kJ/mol=(2Q1+Q2-4Q3)KJ/mol,
由于氢气在氧气中燃烧,反应热△H<0,即(2Q1+Q2-4Q3)<0,
所以2Q1+Q2<4Q3,
故选:C.
点评 本题考查反应热的计算,注意把握从键能的角度计算反应热的方法,放热△H<0是解答的关键点,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.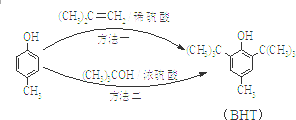 BHT是一种常用的食品抗氧化剂,从
BHT是一种常用的食品抗氧化剂,从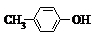 出发合成BHT的方法有如下两种.下列说法不正确的是( )
出发合成BHT的方法有如下两种.下列说法不正确的是( )
 BHT是一种常用的食品抗氧化剂,从
BHT是一种常用的食品抗氧化剂,从 出发合成BHT的方法有如下两种.下列说法不正确的是( )
出发合成BHT的方法有如下两种.下列说法不正确的是( )| A. | 推测BHT在水中的溶解度小于苯酚 | |
| B. | BHT与 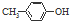 都能使酸性KMnO4褪色 都能使酸性KMnO4褪色 | |
| C. | 方法一和方法二的反应类型都是加成反应 | |
| D. | BHT与 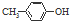 具有完全相同的官能团 具有完全相同的官能团 |
17.下列变化过程中,克服了分子间作用力的是( )
| A. | 食盐熔化 | B. | 氯化氢溶于水 | C. | 干冰气化 | D. | 金属钠熔化 |
4.X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期.X原子的最外层电子数是其电子层数的3倍.Z原子的核外电子数比Y原子少1.下列说法正确的是( )
| A. | 元素非金属性由强到弱的顺序是:X>Y>Z | |
| B. | Y元素最高价氧化物对应水化物的化学式可表示为H4YO4 | |
| C. | 3种元素的气态氢化物中,Z的气态氢化物最稳定 | |
| D. | 原子半径由大到小的顺序为 Z>Y>X |
1.下列事实可证明NH3•H2O是弱碱的是( )
| A. | 氨水能与氯化镁反应生成MgCl2溶液反应 | |
| B. | 氨气易溶于水 | |
| C. | 0.1摩尔/升的NH4Cl的pH值约为5 | |
| D. | 氨水可以使得酚酞试液变红 |
18.下列叙述中,错误的是( )
| A. | 纯水在25℃和80℃时的氢离子浓度,前者小于后者 | |
| B. | 常温下,0.01mol/L的NaOH溶液中,由水电离出的c(H+)为10-2mol/L | |
| C. | pH=6的溶液不一定呈酸性,c(H+)>c(OH-)的溶液才是酸性溶液 | |
| D. | 温度升高,水的离子积常数会增大 |
19.北京大学和中国科学院的化学工作者合作,已成功研制出碱金属与C60形成的球碳盐K3C60.实验测知该物质属于离子晶体,具有良好的超导性.下列关于K3C60的组成和结构分析不正确的是( )
| A. | K3C60中既有离子键又有非极性键 | |
| B. | 1mol K3C60中含有的离子数目为3NA | |
| C. | 该晶体在熔融状态下能导电 | |
| D. | 该物质的化学式不能写作KC20 |
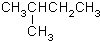
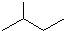 CH3CH=CHCH3
CH3CH=CHCH3
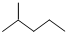 分子式C6H14用系统命名法对该有机物进行命名2-甲基戊烷
分子式C6H14用系统命名法对该有机物进行命名2-甲基戊烷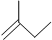 分子式C5H10③
分子式C5H10③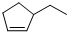 分子式C7H12
分子式C7H12